向体积为2L的密闭容器中加入2molSO2和1molO2,进行可逆反应:催化剂
2SO2+O2 2SO3 反应2min后,测得O2的物质的量为0.8mol,则加热
2SO3 反应2min后,测得O2的物质的量为0.8mol,则加热
(1)2min内,SO2的物质的量减少了_________ SO3的物质的量增加了____________
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)="______________ "
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=" __________ "
(4)2min时SO2的转化率是____________
已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放
出649.5KJ的热量。
(1)写出反应的热化学方程式
(2)已知H2O(l)转化为H2O(g)的△H=44KJ/mol,计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量为。
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
(1)Z2Y的化学式是。
(2)Z2Y2与X2Y反应的化学方程式是。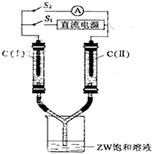
(3)如上图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成,则电解的总反应式为_______________________。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:C(Ⅰ)的电极名称是(填写正极或负极);C(II)的电极反应式是。
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变。请回答:
(1)写出该反应的化学方程式________________________________________
(2) 若t1=15 s,则用B的浓度变化表示的t0~t1阶段的平均反应速率为_____________
(3) 反应起始时B的体积分数为___________
W、X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性
请回答下列问题:
(1)Y在元素周期表中的位置为_________,上述元素的最高价氧化物对应的水化物酸性最强的是_____(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是___________________(用化学符号表示)。
(2) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写单质的化学式)、_________(写出化合物的化学式)。
(3) Y与M的氢化物中,热稳定性更好的是____________(填化学式),原因是_____________________
(4) ZW的电子式为__________,ZW与水反应放出气体的化学方程式为__________________________。
(5)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的X4分子。X4分子结构如下图所示,已知断裂lmolX-X吸收167kJ热量,生成1mo1X2放出942kJ热量。根据以上信息和数据,下列说法正确的是____________。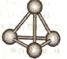
A.X4沸点比P4(白磷)低,属于原子晶体
B.lmol X4气体转变为X2吸收882kJ热量
C.X4与X2互为同素异形体
(6)发射“神六”时用X2W4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知声称1mol水蒸气时放热283.9KJ,写出X2W4 (g)和NO2(g)反应的热化学方程式______________________________________
同时,X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式________________________,指出电解质溶液中OH-离子向________极移动。
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g) 2NH3(g)△H<0达到平衡的标志是__________________________(填编号)
2NH3(g)△H<0达到平衡的标志是__________________________(填编号)
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2 ②各组分的物质的量浓度不再改变
③体系的压强不再发生变化 ④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)= V(NH3逆)
⑦单位时间内3 mol H—H键断裂的同时2 mol N—H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2) 现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖。请用编号填写下列空白:
A.属于原子晶体的是_____________ ,其中熔点最高的是____________
B.属于分子晶体的是_____________________,其中分子构型为直线型的是____________ ,其电子式为_________________
C.含有非极性键的离子化合物是_______________,其中阳离子个数与阴离子个数之比为_________