煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g) + H2O(g)  CO2(g) + H2(g)的平衡常数随温度的变化如下表:
CO2(g) + H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
| |
A |
B |
C |
D |
| n(CO) |
1 |
2 |
3 |
0.5 |
| n(H2O) |
5 |
2 |
3 |
2 |
| n(CO2) |
3 |
1 |
0 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
(4)830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是 。
某有机物A在酸性溶液中加热可发生如下反应:
请回答下列问题:
(1)下列关于该有机物A说法错误的是。
①可发生银镜反应②1molA在一定条件下与氢气反应,最多可消耗5molH2
③能发生消去反应④1molA与烧碱溶液反应,最多可消耗4mol NaOH
(2)有机物B的化学式(分子式)为;B在铂的催化下,与足量氢气发生加
成反应生成X,则X的结构简式为。
(3)有机物R的结构简式为; R与足量的醋酸发生反应(填基本反应类型)的化学方程式为:
。
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。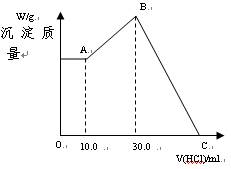
试回答:
(1)A点的沉淀物的化学式为,理由。
(2)写出A点到B点发生反应的离子方程式。
(3)原混合物中MgCl2的质量是,AlCl3的质量是,NaOH的质量是。
(4)C点溶液的体积为mL。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下还原法,在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
(2)还原+6价铬还可选用以下的 试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在 (填序号)最佳,第2次应调节溶液的pH范围约在 (填序号)最佳
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液的最佳试剂为: (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
回答下列问题: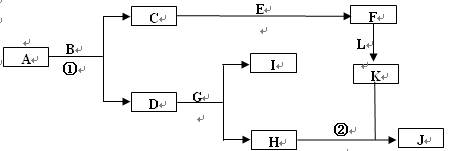
(1)A的电子式。
(2)反应①的化学方程式为,反应②的离子方程式为,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为L。
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)
请回答下列问题:
(1)F的化学式为,H的电子式为,写出反应②的化学方程式;
(2)若A与B均为固体化合物,C是一种能使湿润的红色石蕊试纸变蓝的气体,D是一种中性干燥剂,写出反应①的化学方程式;
(3)若C、D均为常见气体且都能使澄清石灰水浑浊,则A是,B是(写化学式);
(4)若A、C、D均含有氯元素,且A的化合价介 于C、D之间,B、C、D中均含有钾元素,写出常温时①的离子方程式:。
于C、D之间,B、C、D中均含有钾元素,写出常温时①的离子方程式:。