A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO、SO、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题: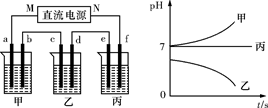
(1)M为电源的 极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为 、 (填写化学式)。
(2)计算电极f上生成的气体为 mol。
(3)写出乙烧杯中的电解反应方程式: 。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为 。
(5)要使丙恢复到原来的状态,应加入适量的 (填 写化学式)。
写化学式)。
下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①,⑥,⑦。
(2)画出原子的结构示意图:④,⑤,⑧。
(3)在这些元素中,最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是。(均填元素符号)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是,碱性最强的是,呈两性的氢氧化物是。
(5)在③与④中,化学性质较活泼的是(填元素符号),怎样用化学实验证明:
答:(该空2分,其余每空1分)
(1)写出下列基团(或官能团)的名称或结构简式:
-CH2CH3、-OH、异丙基:、
醛基、羧基、 —COOR。
(2) (8分) ①0. 1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.2 mol,则该烃的分子式为。结构简式为。
②某烷烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式为,名称为。
(3)按要求表示下列有机物:
(1)按系统命名法命名.
有机物 的名称是 。
的名称是 。
(2)写出下列各种有机物的结构简式
①2,3-二甲基-4-乙基已烷 。
②支链只有一个乙基且相对分子质量最小的烷烃。
③异戊烷(写出键线式)。
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。
(1)由图中所给数据进行分析,该反应的化学方程式为。
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为。
(3)达到平衡是X的浓度是;
(4)当反应进行到第min,该反应达到平衡。反应达到平衡后,下列措施能加快化学反应速率的有。
A.增大反应物的浓度B.升高温度C.使用正催化剂
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A.,B.。(填“能”或“不能”)
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入极(填a或b,下同),电子从 极流出。
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为,B为,C为,D为。(填元素符号)
(2)D的最高价氧化物的水化物的化学式是,E的电子式是。
(3)写出由A、B组成的化合物与E反应的化学方程式:。
(4)请用电子式表示出C和D形成的化合物F的形成过程:。