检验铵盐溶液的方法是:将待测物质取出少量,放在试管中,然后( )
| A.加热,用蘸有浓盐酸的玻璃棒置于试管口检验 |
| B.加热,用湿润的红色石蕊试纸置于试管口检验 |
| C.加强碱溶液后加热,再滴入无色酚酞试液 |
| D.加烧碱溶液后加热,再用湿润的红色石蕊试纸置于试管口检验 |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
向AlCl3溶液中加入过量的NaOH溶液,过滤,洗涤,干燥,加热 |
制取Al2O3 |
| B |
将浓硫酸与碳混合加热,生成的气体通入足量的澄清石灰水 |
检验气体产物中的CO2 |
| C |
分别向等量的A、B两种白色粉末中,加入等体积、等浓度的稀盐酸 |
区分Na2CO3、NaHCO3两种固体 |
| D |
将S02通入品红溶液中,品红溶液褪色,加热褪色后的品红溶液,溶液恢复红色 |
验证亚硫酸的不稳定性 |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH=K2FeO4+2NaOH,下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中NaClO是氧化剂 |
| C.Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
| D.若有2molFeCl3发生反应,转移电子的物质的量为6mol |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2 |
| B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明Cl2有漂白性 |
| C.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| D.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤NaHSO4 ⑥AlCl3 ⑦NaAlO2
| A.①⑤ | B.②③④⑥⑦ | C.①②③④ | D.全部 |
下列反应中,能证明SiO2是酸性氧化物的是
①SiO2+4HF=SiF4↑+2H2O ②SiO2+CaO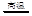 CaSiO3
CaSiO3
③SiO2+2NaOH=Na2SiO3+H2O ④SiO2+2C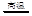 Si+2CO↑
Si+2CO↑
| A.①② | B.②③ | C.③④ | D.①④ |