1)49 g硫酸的物质的量为 mol,若在水中完全电离可产生 molH+ , ______mol
molH+ , ______mol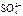 .若有一定量的硫酸完全电离产生
.若有一定量的硫酸完全电离产生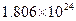 个
个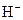 ,此硫酸的质量为 _______g.
,此硫酸的质量为 _______g.
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是 ,相对分子质量为 ; 等物质的量的NH3与H2S质量比为 ; 1.7g氨气与 mol H2O含有的电子数相等。
分析下列列氧化还原反应,回答有关问题。
(1) 2KMnO4+10KI+8H2SO4 =6K2SO4+ 2MnSO4 +5I2十8H2O
被还原的元素,发生氧化反应的物质。
(2) 3Cl2+ 6NaOH=5NaCl + NaClO3+ 3H2O
氧化剂与还原剂的物质的量之比为。
废物回收利用可实现资源再生,并减少污染。如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收再生。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)。
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4(ag)的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq) ====Cu2+(aq)+H2(g)ΔH=+64.39kJ·mol-1
2H2O2(l) ====2H2O (l)+O2(g)ΔH=-196.46kJ·mol-1
H2(g)+ 1/2 O2(g) ="===" H2O (l)ΔH=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O (l)的热化学方程式为
。
(3)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25 ℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
则表示氢氟酸电离的热化学方程式为:
可见氢氟酸的电离是 的(填吸热或放热)。
某原电池构造如下图所示。其电池的总反应是:Cu(s) + 2Ag+ (aq) = Cu2+ (aq) + 2Ag(s)。
请回答以下问题:
(1)若盐桥为琼脂-KOH组成,其作用是___________________________。OH-离子移向_______(填“A”或“B”)中的溶液。Cu为原电池的______极,其电极反应式是_____________________________。A中的电解质溶液在该电池工作一段时间后会出现_______________________的现象。
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池)。
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液c ;A、B是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
① B是极(填“阴”或“阳”) B极逸出(填:黄绿或无色)气体,同时B极附近溶液呈色。
② 电解池中A极上的电极反应式为。
B极上的电极反应式为。
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
① A电极的材料是,电极反应式是 。
② B电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
②下列说法正确的是________。
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为12.8 g,则阳极上产生的气体在标准状况下的体积为L 。
(4)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用 ,阳极材料是用 ,阴极电极反应式为 。
(每空各2 分,共16分)
(1)质量相等的两种物质SO2和SO3,两种物质中分子物质的量之比为___________ ,所含氧原子个数之比为___________
(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为___________ g/mol,则含R 8.0g 的
NaR的物质的量为___________ mol
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为_________L,它与标准状况下________L硫化氢(H2S)含有相同数目的氢原子。
(4)中和浓度为4mol/L,体积为25mLH2SO4溶液,需要NaOH的质量为___________ g。
(5)已知8gA能与32gB恰好完全反应,生成22gC和一定量D,现将16gA与70gB的混合物充分反应后,生成2molD和一定量C,则D的摩尔质量为___ g/mol.