常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA |
NaOH |
混合溶液的pH |
| 甲 |
C(HA)=0.2 mol·L-1 |
C(NaOH)=0.2mol·L-1 |
pH=a |
| 乙 |
C(HA)=c1 mol·L-1 |
C(NaOH)=0.2mol·L-1 |
pH=7 |
| 丙 |
C(HA)="0.1" mol·L-1 |
C(NaOH)=0.1mol·L-1 |
pH=9 |
| 丁 |
pH=2 |
pH=12 |
pH=b |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸? 。
(2)若考虑其他组的实验结果,则c1 (填“<”、“>”或“=”)0.2 mol·L-1;乙组实验中HA和NaOH溶液混合前,HA溶液中C(A-)与NaOH溶液中C(Na+)的关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ;其中,C(A-)= mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前C(HA) (填“<”、“>”或“=”)C(NaOH); b 7(填“<”、“>”或“=”)
(9分)I.某烃类化合物A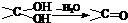 的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
(1)现有以下的实验室仪器:
| A.1H核磁共振仪 | B.质谱仪 | C.红外光谱仪 | D.元素分析仪 |
请你选择分别用什么仪器。
①测出相对分子质量(填字母代号,下同),
②测出官能团碳碳双键,
③测出几种类型的氢。
(2)结合题给信息,可以判断A的结构简式为。
II.(1)多羟基连在同一个碳原子上易自动失水生成醛或酮:,根据上述原理,请写出 与NaOH的水溶液共热的化学方程式为:。
与NaOH的水溶液共热的化学方程式为:。
(2)一个碳原子同时接两个碳碳双键不稳定, 与NaOH醇溶液共热可以生成种稳定的二烯烃。
与NaOH醇溶液共热可以生成种稳定的二烯烃。
(9分)I.按要求完成下列问题
(1) 系统命名为,
系统命名为,
(2)写出间﹣甲基苯乙烯的结构简式,
(3)2,2二甲基丙烷的习惯命名为,
(4)写出4﹣甲基﹣2﹣乙基﹣1﹣戊烯的键线式。
II.糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和A,举一例说明A物质的用途。
(2)氨基酸是组成蛋白质的基本结构单元,甘氨酸的结构简式为:NH2CH2COOH,丙氨酸的结构简式为: CH3CH(NH2)COOH。甘氨酸和丙氨酸混合发生缩合,能生成种二肽化合物。
(3)淀粉的水解产物为葡萄糖(C6H12O6),检验水解产物是葡萄糖的实验过程为:
①在淀粉中加入硫酸后加热一段时间,②加入,③加入新制Cu(OH)2溶液,煮沸。写出③的化学方程式。
(6分)0.2 mol有机物与0.5 mol O2恰好完全燃烧后的产物为CO2和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过碱石灰剩余气体被完全吸收,碱石灰质量增加17.6 g。
(1)燃烧后产物的物质的量分别为CO2________mol、H2O(g)__________mol。
(2)推断该有机物的分子式为_____________。
(3)若0.2 mol该有机物恰好与9.2 g金属钠完全反应,其核磁共振氢谱显示只有两种不同环境的H,试确定该有机物的结构简式为____________。
(8分)填写下列空白:
(1)烃A与含氢量最高的烃B属于同系物。在光照下1体积A最多能与6体积氯气完全反应(同温同压),则A的结构式是。
(2)烃C的相对分子质量是72,C的一溴代物种数是它的同分异构体中最多的,C的名称是。
(3)芳香烃D分子中含56个电子,碳与氢元素质量比为12:1,其加聚反应的化学方程式为。
(4)分子式为C8H10的芳香烃,其苯环上的一氯代物有种。
(8分)按要求回答下列问题:
(1) 的名称为___________________________;
的名称为___________________________;
(2) 的名称为____________________________;
的名称为____________________________;
(3)2,4-二氯甲苯的结构简式为__________________________;
(4)某物质结构如图所示,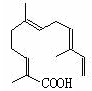
分子式为;
该物质可以与下列(填序号)发生反应。
| A.KMnO4酸性溶液 | B.氢气 | C.溴水 | D.NaOH溶液 |
(5) 中含有的官能团的名称为,。
中含有的官能团的名称为,。
(6)在戊烷的各种同分异构体中,核磁共振氢谱只有一个吸收峰的结构简式为_________________