氮、磷、锌、铁等是与生命活动密不可分的元素。请回答下列问题:
(1) NH3和PH3都是极性分子,其中极性较大的是______,理由是 。
(2) 20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是 。
(3) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式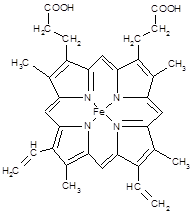
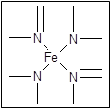
血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出Fe2+的配位键。
(4) N2与CO互为等电子体。下表是两者的键能
数据(单位:kJ·mol-1): 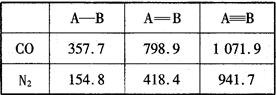
结合数据说明CO比N2活泼的原因:_____。
(5) Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是 。
对于反应:2SO2+O2===2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格里(填“增大”、“减小”或“不变”)
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
恒压下充入Ne |
|
| ③ |
增大O2的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充入Ne |
下图是利用石油为原料合成增塑剂G的基本流程: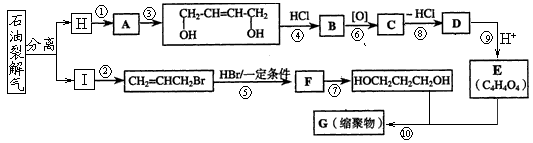
请完成下列各题:
(1)反应⑧条件是。
(2)写出反应⑦的化学方程式:。
(3)B被氧化成C的过程中会有中间产物生成,该中间产物可能是(写出一种物质的结构简式),检验该物质存在的试剂是。
(5)写出相对分子质最小,跟E互为同系物的有机物的结构简式_________________,写出G的结构简式。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下: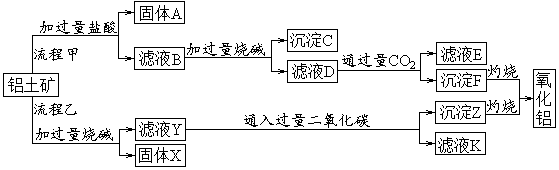
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
(2)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(3)滤液E、K中溶质的主要成份是_____(填化学式),写出该溶液的一种用途________
(4)已知298K时,Mg(OH)2的容度积常数Ksp=5.6×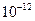 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=______。
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=______。
盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
A.40.32L B.30.24L C.20.16L D.6.72L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是,反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为。
有一固体混合物可能含有氯化铁、亚硝酸钠、硝酸银、氯化铜、硝酸钠、熟石灰和氯化铵等7种物质。将混合物溶于水得白色沉淀和无色溶液。白色沉淀可溶于氨水中。无色溶液与强碱共热放出的气体可使酚酞变红。无色溶液也可使酸性高锰酸钾溶液褪色。无色溶液受热时可放出氮气。
已知:Ksp(AgNO2)=6.0×10-4;Ksp(AgCl)=1.56×10-10
回答下列问题(用化学符号回答):
(1)该固体混合物中肯定存在的物质是________________,肯定不存在的物质是_______________。
(2)混合物溶于水时所得的白色沉淀中肯定有________________。该沉淀溶于氨水的离子方程式为_______________________________________。
(3)无色溶液中,使酸性高锰酸钾褪色的物质是___________________。
(4)写出无色溶液受热时放出氮气的化学方程式__________________。