下图是利用石油为原料合成增塑剂G的基本流程: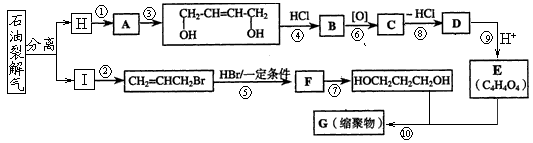
请完成下列各题:
(1)反应⑧条件是 。
(2)写出反应⑦的化学方程式: 。
(3)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(5)写出相对分子质最小,跟E互为同系物的有机物的结构简式_________________,写出G的结构简式 。
已知几种难溶电解质的溶度积如下表所示:
| 几种难溶电解质的Ksp(25℃) |
|
| 沉淀溶解平衡 |
Ksp |
AgBr(s) Ag+(aq)+Br-(aq) Ag+(aq)+Br-(aq) |
5,0×10-13mol2·L-2 |
AgI(s) Ag+(aq)+I-(aq) Ag+(aq)+I-(aq) |
8.3×10-17mol2·L-2 |
FeS(s) Fe2+(aq)+S2-(aq) Fe2+(aq)+S2-(aq) |
6.3×10-18mol2·L-2 |
ZnS(s) Zn2+(aq)+S2-(aq) Zn2+(aq)+S2-(aq) |
1.6×10-24mol2·L-2 |
CuS(s) Cu2+(aq)+S2-(aq) Cu2+(aq)+S2-(aq) |
1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为:。
(2)向饱和的AgI溶液中加入固体硝酸银,则c(I-)(填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+)(填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s) Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是。
| A.加入少量CuS固体 | B.加入少量FeS固体 |
| C.加入少量FeCl2固体 | D.加入少量CuCl2固体 |
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”、“向右”或“不”);使用催化剂反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”、“向右”或“不”);使用催化剂反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中
c(NH4+)=c(Cl-)。则溶液显性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=。
ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是________________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
( 共9分)、某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A。它们的转化关系如下:
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出A、B、C、D、E、F的结构简式和名称;
A
B
C
D
E
F
(2)写出实现①、⑥转化的化学方程式,并注明反应类型。
①
⑥
( 共5分)、某有机物的键线式如下: ,该有机物分子含个碳原子,个氢原子,个氧原子,其分子式是。
,该有机物分子含个碳原子,个氢原子,个氧原子,其分子式是。