【原创】(13分)根据下列有机物的结构完成问题

(1)可鉴别风信子醛和冬青油的试剂是 。
(2)下列关于冬青油和突厥酮的说法中正确的是 (填序号)。
| A.都属于芳香族化合物 | B.都能使酸性高锰酸钾溶液褪色 |
| C.突厥酮的分子式为C13H20O | D.都能发生水解反应 |
(3)突厥酮与溴水反应的化学方程式为 。
(4)写出符合下列条件的风信子醛的同分异构体的结构简式______;(任写一种)
a.含有苯环,苯环上有两个支链
b.与新制氢氧化铜浑浊液共热无砖红色沉淀芳香烃
下面是一个合成反应的流程图。A—G均为有机物,反应中产生的无机物均省略,第一步反应中的试剂与条件有的已注明、有的未注明。根据图填空: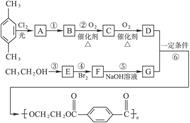
(1)写出D的分子式____________________,G的结构简式________________。
(2)写出下列化学反应方程式并注明反应类型
反应②___________________________,____________。
反应⑤___________________________,____________。
反应⑥___________________________,____________。
(3)写出两种符合括号内条件的D的同分异构体的结构简式(苯环上有两个取代基,在对位且属于酯类):
_____________________________、_____________________________。
(4)试计算该流程中,每生产1.00吨高分子化合物,理论上消耗NaOH固体_______吨。
(5)绿色化学追求充分利用原料中原子,实现零排放或少排放。就该流程中大量消耗NaOH,谈一谈你的建议或设想:
______________________________________________________________________________。
(9分)葡萄糖是人类的营养素。在人体里。富氧条件下氧化生成CO2和H2O;在缺氧条件时,则生成一种有机酸A。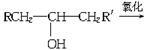

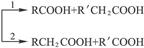
已知:将A进行如下图所示的反应。其中C和C′是同系物。C′是甲酸(HCOOH)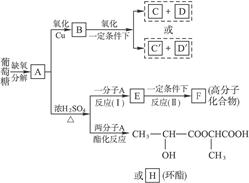
完成下列问题:
(1)C和D′属于_________(用编号填入,以下同)。
①同系物②同分异构体③同类物质④同素异形体
(2)D′与E分别属于哪一类化合物:D′_________,E_________。
①多元醇②醛③不饱和羧酸④多元羧酸⑤酯
(3)写出结构简式:A_________,F_________,H_________。
(4)写出反应类型:Ⅰ__________,Ⅱ__________。
(5)写出A→E的化学反应方程式:_____________________________。
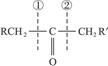
已知: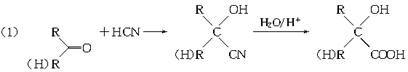
(2)R—CHCH2+HBr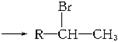
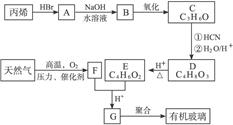
有机玻璃可按下列路线合成:
F亦可由水煤气在高温、高压、催化剂存在下合成。试写出:
(1)天然气的主要成分和C的结构简式分别为_________、_________。
(2)E+F G的反应方程式为______________________________________。
G的反应方程式为______________________________________。
(3)丙烯 A和A
A和A B的反应类型分别属于___________、___________。
B的反应类型分别属于___________、___________。
(4)G 有机玻璃的反应方程式为__________________。
有机玻璃的反应方程式为__________________。
某多肽在小肠液的作用下完全水解得到甘氨酸 (相对分子质量为75)、丙氨酸
(相对分子质量为75)、丙氨酸 (相对分子质量为89)、半胱氨酸
(相对分子质量为89)、半胱氨酸 (相对分子质量为121)三种氨基酸。现称取该多肽830 g,完全水解后共得到1010 g氨基酸,经分析该氨基酸混合物的平均相对分子质量为100,1 mol多肽含硫原子50 mol。问:
(相对分子质量为121)三种氨基酸。现称取该多肽830 g,完全水解后共得到1010 g氨基酸,经分析该氨基酸混合物的平均相对分子质量为100,1 mol多肽含硫原子50 mol。问:
(1)若使上述氨基酸中的氮全部转化为铵盐,并加碱中和,全部蒸出氨气,可得氨气_____
________g。
(2)一分子此多肽完全水解生成________个氨基酸。
人造羊毛的主要成分为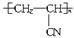 ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品。
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品。
完成下列问题:
(1)A的分子式为____________,D的结构式为____________。
(2)在反应①—⑥中,属于加成反应的是____________,属于裂化反应的是____________。
(3)写出反应⑥的化学方程式____________________________________________________。
(4)从能源和环保的角度看,你认为最有发展前景的是_________________________,理由是___________________________________________________________________________。