[化学—化学与技术]
海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河人海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用: (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通人到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”).

(3)用苦卤(含Na+、K+、Mg2+CL-、Br-等离子)可提取溴,其生产流程如下:
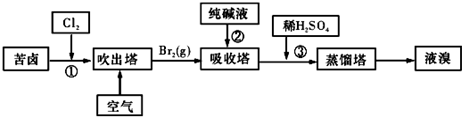
①若吸收塔中的溶液含BrOf,则吸收塔中反应的离子方程式为: .
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? 。
③向蒸馏塔中通人水蒸气加热,控制温度在90°C左右进行蒸馏的原因是 。
乙烯的产量可以用来衡量一个国家的石油化工发展水平。请回答:
(1)若将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为:____________________。
(2)可以用来除去乙烷中混有的乙烯的试剂是______。(填序号)
①水②氢气③溴的四氯化碳溶液④酸性高锰酸钾溶液
(3)在一定条件下,乙烯能与水反应生成有机物A.A的结构简式是_____,其反应类型是______反应(填“取代”或“加成”)。
(4)下列化学反应原理相同的是______(填序号)
①乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色;
②SO2使溴水和酸性高锰酸钾溶液褪色;
③SO2使品红溶液和滴有酚酞的NaOH溶液褪色;
含氮废水进入水体中对环境造成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO还原成N2,从而消除氮污染。
(1)配平以下有关的离子反应方程式:
□NO3—+□Al+□ H2O―→□ N2↑+□ Al(OH)3+□OH-
(2)以上反应中失电子的物质是________,还原产物是________,每生成1 mol还原产物,将有___个电子发生转移。
(3)现需除去1 m3含氮0.3 mol的废水中的NO(设氮元素都以NO的形式存在),则至少需要消耗金属铝的物质的量为________。
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是(写出计算过程)。
(2)X与金属钠反应放出氢气,反应的化学方程式是。
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是。
(4)X与酸性高锰酸钾溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W。若184 g X和120 g Z反应能生成106 g W,计算该反应的产率(实际产量与理论产量之比)。
用(相同的物质、同素异形体、同系物、同分异构体、同位素)填空
(1)2-甲基丁烷和丁烷 ________________。
(2)正戊烷和2,2-二甲基丙烷___________________。
(3)间二甲苯和乙苯_____________________ 。
(4)1-已烯和环已烷_________________。
(5)白磷和红磷____________________。
写出下列反应的化学方程式:
(1)用苯制溴苯的反应 ;
(2)丙醇的催化氧化反应 ;
(3)乙烯通入到溴的四氯化碳溶液中:;
(4)苯与浓硝酸、浓硫酸混和后加热至50℃ ~60℃ 发生反应:。
(5)甲烷与氯气光照(假设产物是二氯甲烷);
(6)乙酸与乙醇的酯化反应;
(7)丙烯的加聚反应。