对于反应:2SO2+O2===2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格里(填“增大”、“减小”或“不变”)
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
恒压下充入Ne |
|
| ③ |
增大O2的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充入Ne |
|
(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
(12分)Ⅰ.(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示: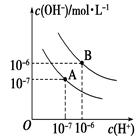
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因:。
(1)甲烷通常用来作燃料,其燃烧反应的化学方程式是。
(2) 若用甲烷—氧气构成燃料电池,电解质溶液为KOH溶液,试写出该电池的正极的电极反应式;负极的电极反应式。
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答:
(1)实验中观察到的现象是____________________。(选填代号)
| A.试管中镁片逐渐溶解 | B.试管中产生无色气泡 |
| C.烧杯外壁变冷 | D.烧杯底部析出少量白色固体 |
(2)试管中发生的反应属于____________________(选填“氧化还原反应”或“非氧化还原反应”)。
(3)写出有关反应的离子方程式________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
(10分,每空2分)往一个容积为5L的密闭容器中,通入2molN2和3molH2,在一定条件下,发生反应 N2+3H2 2NH3,2 min后测得容器中生成了1mol NH3,试求:
2NH3,2 min后测得容器中生成了1mol NH3,试求:
(1)2 min时,N2的物质的量;(2)2 min时,H2的物质的量浓度;
(3)2 min时,H2的转化率;(4)2min内,N2的平均反应速率;
(5)N2、H2、NH3的反应速率之比。