海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用: (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。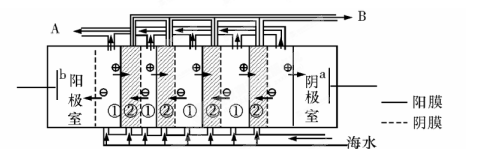
(3)用苦卤(含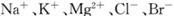 等离子)可提取溴,其生产流程如下:
等离子)可提取溴,其生产流程如下: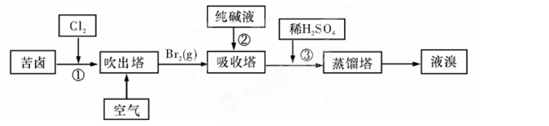
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为: 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O反应中,_________是氧化剂;_________是还原剂;_________元素被氧化;_________元素被还原;_________是氧化产物;_________是还原产物;被还原的HNO3与参加反应的HNO3物质的量之比是_________。
将下列离子Na+、K+、Cu2+、H+、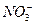 、Cl-、
、Cl-、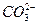 、OH-按可能大量共存于同一溶液的情况,把它们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
、OH-按可能大量共存于同一溶液的情况,把它们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:_______________________________________;
B组:_______________________________________。
通常采用NaHCO3的悬浊液除去混在CO2中的少量HCl气体,其反应的离子方程式是___________________,不用NaOH溶液的原因是________________________________,反应的离子方程式是_______________________________;也不用饱和Na2CO3溶液的原因是_________________________________,其离子方程式是______________________________。
(1)写出镁在CO2中燃烧的化学方程式______________________________。
(2)利用上述原理,中国科技大学一个研究组在440 ℃和800 atm条件下,利用Na与CO2作用得到了金刚石,且有望达到宝石级,给天然金刚石开采业带来极大挑战。写出由钠得到金刚石的化学方程式
_______________________________________________________________。
溴酸钾与溴化钾在酸性溶液中反应,溴元素完全转化成单质溴,试写出反应的离子方程式:__________________________,该反应中,___________mol溴酸钾中含有m g溴元素。它能___________(填“氧化”或“还原”)___________ mol的 Br-。