下列说法正确的是( )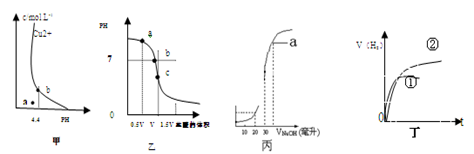
A.图甲表示某温度下,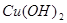 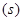 在溶液中达到沉淀溶解平衡后,改变溶液PH, 在溶液中达到沉淀溶解平衡后,改变溶液PH,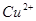 浓度的变化。由图可知 浓度的变化。由图可知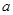 点溶液未达到饱和,因此, 点溶液未达到饱和,因此,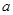 点的 点的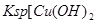 ]小于 ]小于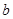 点。 点。 |
B.图乙表示在室温时用一定浓度的盐酸滴定V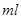 同浓度的氨水。 同浓度的氨水。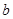 点时溶液中 点时溶液中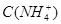 = =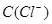 ,且溶液中水的电离程度最大。 ,且溶液中水的电离程度最大。 |
C.图丙表示在室温时,用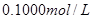 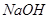 溶液滴定30.00ml0.1mol/L 溶液滴定30.00ml0.1mol/L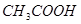 溶液,点a所示溶液中C( 溶液,点a所示溶液中C( > >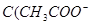 )> )>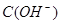 > >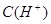 |
D.图丁可表示同体积同PH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应生成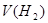 随时间( 随时间(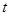 )的变化情况。 )的变化情况。 |
向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同温度下,发生反应:A(g)+B(g) xC(g)△H<0测得两容器中c(A)随时间t的变化如图所示。
xC(g)△H<0测得两容器中c(A)随时间t的变化如图所示。
下列说法正确的是()
A.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
B.将乙容器升温可使甲、乙容器内各物质的体积分数相同
C.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/ L
D.x不可能等于2
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是()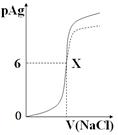
(提示:KspAgCl>KspAgI)
| A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 |
| B.图中x点的坐标为(100,6 ) |
| C.图中x点表示溶液中Ag+ 与Cl- 浓度相同 |
| D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 |
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是()
| A.吸收H2S的离子方程式为:2Fe3++H2S→2Fe2++S↓+2H+ |
| B.电解过程中的阳极反应主要为:2Cl-—2e-→Cl2 |
| C.该工艺流程体现绿色化学思想 |
| D.实验室可用点燃充分燃烧的方法消除H2S污染 |
下列根据实验操作和现象所得出的结论不正确的是()
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
SO2通入酸性高锰酸钾溶液 |
高锰酸钾溶液褪色 |
SO2具有还原性 |
| C |
溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 |
出现淡黄色沉淀 |
溴乙烷发生了水解 |
| D |
向等浓度的KBr、KI混合液中滴加AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgBr)>Ksp(AgI) |
某强碱性溶液中含有的离子是:K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验:
①取少量的溶液用足量硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加人盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
③另取一定量的原溶液中加人5 mL0. 2 mol/L盐酸时,沉淀会完全消失,加人足量的硝酸银溶液可得到沉淀0.187 g。下列说法中正确的是 ()
| A.该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有A13+、CO32-、Cl- |
| C.Cl-可能含有 |
| D.该溶液中一定含有AlO2-、CO32-、Cl- |