新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度 越大。
越大。
H2CO3 
 + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7

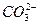 +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11
HclO  H++
H++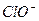 Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
实验一、定性研究:
① 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,
有少量气泡产生,溶液浅黄绿色褪去;
② 过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③ 为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
① 反应后所得的溶液漂白性增强的原因是______ ___________ ____
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有_______ 。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状 碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液 面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。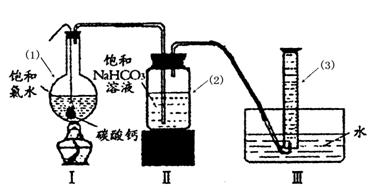
请回答:
③写出仪器(1)与仪器(3)的名称
(1) (3)
④为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
⑤如何准确读出量筒中气体的体积
a________ _
b 上下移动量筒至量筒内液面与水槽液面相平
c
我们知道“喷泉”是一种常见的自然现象,其产生的原因是存在压强差。
(1)图甲为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管与烧杯中分别盛有液体。挤压滴管的胶头,下列与实验事实不相符的是()
A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3溶液)/白色喷泉
(2)某学生积极思考产生喷泉的其他方法,并设计了图乙所示装置。
①在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
这种方法产生喷泉的原理是
②在图乙锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
③比较上述图甲和图乙两套装置,从产生喷泉原理来分析,图甲是上部烧瓶内压强;图乙是下部锥形瓶内气体压强(均填“增大”或“减小”)。
(3)城市中常见的人造喷泉及火山爆发的原理与上述(填“图甲”或“图乙”)装置的原理相似。
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式:。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。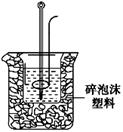
①实验时所需的玻璃仪器除烧杯、量筒外还需:。
②该装置中有一处错误是:,如果用该错误装置测定,结果会(填“偏高”“偏低”“无影响”)
③如果,该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理由是:。在该实验中需要测定某种数据,完成一次实验,需要测定该数据的次数为次。
④若反应前溶液以及中和后的混合液的密度均设为 1 g/cm3,混合前酸与碱的温度均为t1,混合后溶液的温度为t2,比热容为 4.18 J/(g·℃)。那么该生测定中和热:ΔH=。
(3)学生乙用2 mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图(Ⅰ)装置: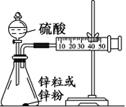
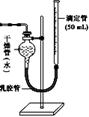
图Ⅰ图Ⅱ
①该生两次实验测定时间均设定为10 min,那么他还要测定的另一个数据是:
。
②如果将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所处的刻度数,发现滴定管中液面高于干燥管中液面,应先采取的操作是:。
③该实验结果中,你估计与酸反应较快的是。
(12分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
请根据要求回答下列问题:
(1) 写出该反应的化学方程式
(2)此反应中浓硫酸的作用是
饱和碳酸钠的作用是
(3)若采用同位素示踪法研究该化学反应,反应物无水乙醇中含有18O,冰醋酸中均为16O,反应后的混合物中,含有18O的物质有
(4)若用如图所示装置来制备少量的乙酸乙酯,锥形瓶中的现象为,不过往往产率偏低,其原因可能为(任填2种)
(8分) 某学生为验证苯的沸点(80.1℃)比水低,设计了如右图1所示的实验装置:(某些固定装置已略去)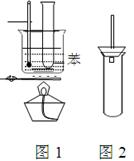
(1)该实验中能够说明苯的沸点比水低的实验现象是。
(2)使用该实验装置的一个明显的缺点就是难以控制苯蒸气的大量外逸,有人在盛苯的试管口装上一个带有直玻璃导管的塞子(如右图2所示) ,改进后装置的直玻璃导管能防止苯蒸气的大量外逸的原因是
(3)该实验的加热方法叫加热, 其优点是
(8分)用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A 100 mL量筒 B玻璃棒 C 50 mL容量瓶 D 10 mL量筒
E 胶头滴管 F 50 mL烧杯 G 100 mL容量瓶
(1)需量取浓硫酸的体积为mL,
(2)实验时不选用的仪器有(填序号),
(3)配制过程中,下列情况会使配制结果偏高的是(填序号) ,
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④浓硫酸在烧杯中稀释后未冷却到室温就转移到容量瓶中定容
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用蒸馏水洗净后,再用待配液润洗 |
| C.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀 |
| D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线 |