(8分)用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A 100 mL量筒 B玻璃棒 C 50 mL容量瓶 D 10 mL量筒
E 胶头滴管 F 50 mL烧杯 G 100 mL容量瓶
(1)需量取浓硫酸的体积为 mL,
(2)实验时不选用的仪器有(填序号) ,
(3)配制过程中,下列情况会使配制结果偏高的是(填序号) ,
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④浓硫酸在烧杯中稀释后未冷却到室温就转移到容量瓶中定容
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用蒸馏水洗净后,再用待配液润洗 |
| C.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀 |
| D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线 |
下图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
(1)左边大试管中要加入几片碎瓷片,其作用是
(2)该装置中使用的玻璃管较长,其作用是
(3)烧杯中还应该加入的物质是
实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
(1)溶解时
(2)过滤时
(3)蒸发时
可用于分离或提纯物质的方法有:①过滤②蒸馏③加热④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和苯的混合物
(11分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: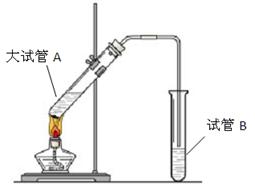
(1)写出制取乙酸乙酯的化学反应方程式:
(2)试管B中盛放的溶液是,其主要作用是
。
(3)装置中通蒸气的导管不能插入试管B的溶液中,目的是 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(5)做此实验时,往往还向大试管A中加入几块碎瓷片,其目的是 。
(6)用30g乙酸与46g乙醇反应,如果实际产量是理论产量的67%,则实际得到乙酸乙酯的质量是 。
| A.44g | B.29.5g | C.74.8g | D.88g |
图2是研究甲烷取代反应实验装置图,具体的实验方法是:
取一个100 mL的大量筒,先后收集20 mL CH4和80 mL Cl2,进行实验。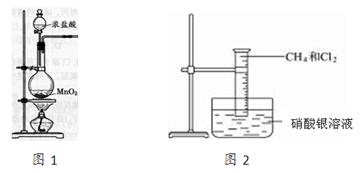
(1)实验室制取氯气的装置如上图1所示,请写出烧瓶中的反应方程式为:
。浓盐酸在反应中体现了
性和性。
(2)下列常用的干燥剂中,不能干燥氯气的是。
| A.浓硫酸 | B.P2O5 | C.无水氯化钙 | D.碱石灰 |
(3)氯气是色的有毒气体,实验中剩余的氯气可用NaOH溶液吸收,请写出发生的离子方程式:。
(4)若研究甲烷与氯气的取代反应,还需要的条件是___________。若将如图2所示装置放在强光下照射会有_________________(填可能发生的不良后果)。
(5)若量筒中的甲烷和氯气的量比较大,放在光亮的地方足够长的时间,下方水槽中的现象是_________________________________,产生此现象的原因是:__________________________(用简要的文字和方程式说明)。