二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1) 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,其吸收的化学反应方程式为  再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(2) 工业上生产硫酸时,将SO2氧化为SO3是关键一步。
① 某温度下,SO2(g)+1/2O2(g) SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应
SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应 达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K= 。
达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K= 。
② 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
| A.保持温度和容器压强不变,充入2mol SO3 |
| B.保持温度和容器体积不变,充入2mol N2 |
| C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2 |
| D.升高温度 |
E、移动活塞压缩气体
(3) 某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极的电极为 极; 写出通入SO2的电极的电极反应式: 。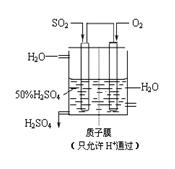
⑴加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。(列出计算过程)
⑵过氧化钠与铝粉混合物共18.3g,加入100ml 水,充分反应后混合物完全溶解,并收集到5.6L气体(标准状况).则收集到的气体成份是,体积比是。
某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题: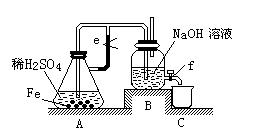
⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为:,B中可以观察到的现象是。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是,
有关反应的化学方程式是
物质有以下转化关系: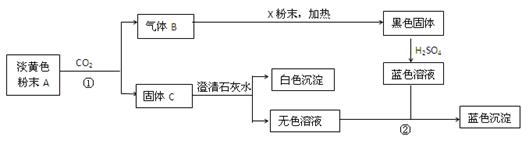
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是,B是,C是,X粉末是。
(2)写出反应①的化学方程式。
(3)写出反应②的离子方程式。
某无色透明溶液,投入金属铝可放出H2。现有下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、
HCO3-、OH-。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
(1)当生成Al3+时,可存在的离子有;
(2)当生成AlO2-时,可存在的离子有。
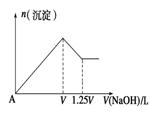
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与
Al2(SO4)3的物质的量浓度之比为 ___________