已知某KOH样品中含水7.62%,含K2CO32.23%,含KOH90%。现将1.00g样品加入46.00mL1.00mol/L的盐酸中,过量的酸用1.070mol/LKOH溶液刚好中和。蒸发溶液,蒸发到无水时,可得到固体的质量约为
| A.3.00g | B.3.43g | C.4.50g | D.无法计算 |
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
A.该反应的化学方程式为3B+4D 6A+2C 6A+2C |
B.反应进行到1 s时, = = |
| C.反应进行到6s时,B的平均反应速率为0.05 mol/(L·s) |
| D.反应进行到6s时,各物质的反应速率相等 |
对于A2+3B2 = 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.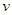 (A2)=0.4 mol·L-1·s-1B.
(A2)=0.4 mol·L-1·s-1B.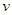 (B2)=0.8 mol·L-1·s-1
(B2)=0.8 mol·L-1·s-1
C.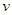 (C)=0.6 mol·L-1·s-1D.
(C)=0.6 mol·L-1·s-1D.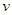 (D)=0.6 mol·L-1·min-1
(D)=0.6 mol·L-1·min-1
一定条件下,分别对反应C(s)+CO2(g)  2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
| A.①②③④ | B.①③④ | C.①② | D.①③ |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由强到弱的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是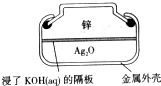
| A.Zn作负极 |
| B.电子经外电路流向Ag2O极 |
| C.K+向Zn极移动 |
| D.正极反应:Ag2O+H2O+2e-=2Ag+2OH- |