(8)向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如下图所示,试回答下列问题: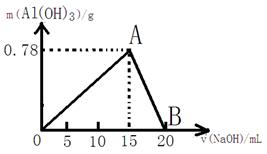
(1)上述两步反应用总的离子方程式可表示为: ;
(2)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为 。
(写出计算过程)
据报道,某煤矿井下采煤面瓦斯突出,发生爆炸,当场造成56人死亡,92人生死不明。截至记者发稿时,经过全力搜救,目前又发现4名遇难矿工遗体,死亡人数增加至60人。其中,55人系窒息死亡。目前,尚有88名矿工下落不明。根据以上信息回答下列问题:
(1)写出瓦斯爆炸的化学方程式
(2)可燃性气体的爆炸都有一个爆炸极限,所谓爆炸极限是指可燃气体(或蒸汽或粉尘等)与空气混合后,遇火产生爆炸的最高或最低浓度(通常以体积百分数表示)。下表是甲烷在空气和纯氧气中的爆炸极限
| 空气中 |
纯氧气中 |
|
| 甲烷的爆炸极限 |
5.0~15% |
5.0~60% |
下面是瓦斯和空气组成的混和气体中瓦斯的体积含量,从是否能够爆炸方面考虑,请判断哪些是不安全的
A.3% B.10% C.30% D.60%
(3)请分析人为什么在瓦斯爆炸的矿中会窒息死亡:
(4)由矿井中的瓦斯爆炸,根据你的化学实验经验,你可以得出什么启示?
如图所示,将等物质的量的Cl2和CH4充入一容积为 25 mL的量筒,并将量筒倒置在盛有饱和食盐水的水槽中,用日光散射,可观察到的现象是;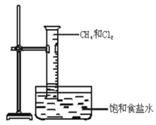
①
②
③
④
有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族。
(1)写出元素符号:X__________,Y___________,Z__________,W___________。
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是。
(3)把Z的单质(片状)放入滴有酚酞的沸水中,现象是____________反应的化学方程式是_____________________________________________。
我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业作出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、NH3和CO2为原料制得NaHCO3,进而生产出纯碱。相关的化学反应有:①NH3+CO2+H2O===NH4HCO3;②NH4HCO3+NaCl===NaHCO3↓+NH4Cl;③2NaHCO3 Na2CO3+CO2↑+H2O↑。某研究性学习小组的同学模拟“侯氏制碱法”,提出下列三种制备NaHCO3的实验方案。
Na2CO3+CO2↑+H2O↑。某研究性学习小组的同学模拟“侯氏制碱法”,提出下列三种制备NaHCO3的实验方案。
方案1:分别将CO2和NH3通入到饱和食盐水中;
方案2:将CO2通入到含NH3的饱和食盐水中;
方案3:将NH3通入到含CO2的饱和食盐水中。
(1)经过讨论,大家一致认为方案2较合理,请说明方案3的不足之处
________________________________________________________________________。
(2)根据方案2,某同学设计了如下实验步骤和装置图:
步骤1:配制含氨的饱和食盐水。在100 mL锥形瓶中加入20 mL氨水(体积比1∶1),再加入8 g食盐,塞紧橡皮塞,振荡几分钟,过滤除去不溶物,得到含氨的饱和食盐水。
步骤2:制备NaHCO3。按图组装实验装置,先检查装置的气密性,再向各仪器中加入相应的试剂制备NaHCO3。实验过程中,需要控制温度在30~35 ℃(大于35 ℃时NH4HCO3会分解)和CO2的通入速度(以出现能数得清的连续气泡为宜)。反应结束后,把锥形瓶浸入冷水中,使较多的晶体析出,过滤、洗涤。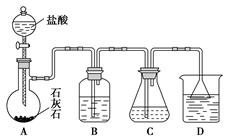
请回答下列问题:
①为控制反应温度在30~35 ℃,应采用的操作方法是________________________。
②装置B中的试剂是__________________,它的作用是__________________________。
③检验步骤2中所得晶体是NaHCO3而不是NaCl的实验方法和现象是
________________________________________________________________________
________________________________________________________________________。
④设计一个简单的实验方案证明Na2CO3溶液呈碱性是由CO32-引起的
________________________________________________________________________
________________________________________________________________________。
已知30 ℃时几种盐的溶解度(g/100 g H2O)
| 物质 |
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
| S/g |
36.3 |
27.0 |
11.1 |
41.1 |
1862年比利时索尔维以CO2、NH3、水为原料制得纯净的Na2CO3,这种制碱法叫索尔维法,其主要操作是:
①在氨化的饱和NaCl溶液中通入CO2制得小苏打;
②再把小苏打焙烧,制得纯碱,而副产物CO2可循环使用;③在析出小苏打的母液中加入生石灰,逸出的NH3循环使用。
1943年我国著名化学家侯德榜先生改进了“索尔维法”,用固体NaCl代替生石灰加入母液中,使NH4Cl晶体析出,生产纯碱和NH4Cl,这便是“侯氏制碱法”。
试回答:
(1)该方法能制得小苏打的原因是
________________________________________________________________________
______________________________。
(2)不能在NaCl溶液中先通入CO2,然后再通NH3制得NaHCO3的原因是
________________________________________________________________________。
(3)在析出小苏打后的母液中加入生石灰发生反应的化学方程式为:
________________________________________________________________________。
(4)“侯氏制碱法”的化学原理中涉及的化学反应类型有________。
A.化合 B.分解
C.置换 D.复分解