(10分)脱羧反应形成新的C-C键为有机合成提供了一条新的途径,例如:

(1)化合物I含有的官能团名称是______________。
(2) 与
与 也能发生脱羧反应,有机产物的结构简式为 。
也能发生脱羧反应,有机产物的结构简式为 。
(3)化合物III与新制氢氧化铜反应的化学方程式为 。
(4)下列有关化合物Ⅲ的说法正确的是 。
| A.化合物无Ⅲ分子式为C14H15O |
| B.1mol化合物Ⅲ最多可以与6mol H2反应 |
| C.化合物无Ⅲ分子中的所有碳原子一定处于同一平面 |
| D.化合物Ⅲ既可以发生氧化反应和还原反应,也可以发生加成反应和取代反应 |
(5)写出符合下列条件的化合物的同分异构体 。
①化合物I的最简单同系物
②苯环上有两种不同类型的氢原子
根据下面的反应路线及所给信息填空: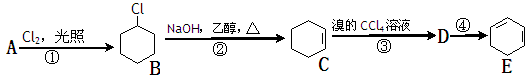
(1)A的结构简式是,名称是;
(2)填写以下反应的反应类型:①;②;③;
(3)反应④的反应试剂及反应条件;
(4)反应②的化学方程式为;
B水解的化学方程式为。
14分)0.3 mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则有g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A跟HCl反应后,生成产物中的H原子的结构环境完全相同,写出该反应的化学方程式____。
(4)若一分子烃A被酸性高锰酸钾溶液氧化后,能够生成两分子B,则结构简式分别为:
A、B。
(5)若烃A与Br2的CCl4溶液反应后的产物为1,2-二溴丁烷,请写出由烃A发生加聚反应的化学方程式。
下面A~F是几种常见烃的分子球棍模型。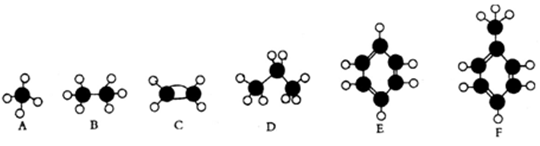
根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是。
(2)能够发生加成反应的气态烃是。
(3)一氯代物的同分异构体最多的是。
(4)所有原子均在同一平面上的是。
(5)能使酸性高锰酸钾溶液褪色的是(填对应字母)。
出下列反应化学方程式,并写出该反应属于何反应类型。
(1)乙烯使溴水退色; 。
(2)苯与浓硫酸和浓硝酸的混合液共热;。
(3)由乙炔制聚氯乙烯;。
(4)乙烷与Cl2在光照条件下1:1反应:;___________。
(5)3—甲基—1—丁炔与溴的四氯化碳溶液按物质的量为1:1反应:;_____________。
(6)用甲苯制2,4,6-三溴甲苯:;__________。
(9分)A、B都是芳香族化合物,1摩尔A水解得到1摩尔B和1摩尔乙醇。A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A的溶液能使FeCl3溶液显色。
(1)A、B的分子量之差为。
(2)1个A分子中应该有个氧原子。
(3)A的分子式是。
(4)A可能的三种结构简式是、、。