(16分)(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 
A.C(s)+H2O(g)=" " CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)= 2H2O(1) △H<0
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为 。通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的状态,则电解过程中转移的电子的物质的量为 
②若电解含有1molNaCl溶液400ml,当阳极产生的气体448mL(标准状况下)时,溶液的C(OH—) = (假设电解后溶液体积不变)。
、资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=" -76.0" kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H="+113.4" kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g) 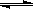 C H4 (g)+2 H2O(g)
C H4 (g)+2 H2O(g)
向一容积为 2 L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则300℃时上述反应的平衡常数K=____________________。 200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)0。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能 b、太阳能转化为电能
c、太阳能转化为化学能 d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-
则阳极的电极反应式为___________________。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。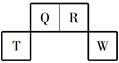
(1)T的原子结构示意图是______。用化学方程式表示工业上常用于冶炼T单质的原理是_________。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中的共价键类型是________。
(3)元素的非金属性:Q________W(填“强于”或“弱于”),结合方程式简述其原因是___________。
(4)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式___________________________________。
利用铜萃取剂M,通过如下反应实现铜离子的富集: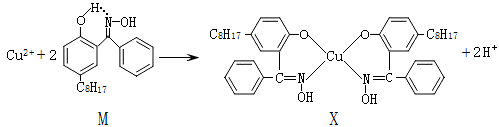
(1)X难溶于水、易溶于有机溶剂,其晶体类型为。
(2)M所含元素的电负性由大到小顺序为,N原子以轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是。
(5)基态Cu2+的外围电子排布式为,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是。
| 离子 |
Sc3+ |
Ti3+ |
Fe2+ |
Cu2+ |
Zn2+ |
| 颜色 |
无色 |
紫红色 |
浅绿色 |
蓝色 |
无色 |
I.甲、乙、丙、丁四种物质存在转化关系:
(1)若甲、乙均为空气主要成分,甲所含元素的简单阴离子的结构示意图为。
(2)若乙是生活常见金属单质,丙→丁的离子方程式为。
(3)若丙既能与强酸又能与强碱反应,则丙的化学式为(任写1种)。
II.一定温度下,容积为1 L的密闭容器中投入0.5 mol PCl5(g),存在平衡:PCl5(g) PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
| 时间 |
n(PCl5)/mol |
n(PCl3)/mol |
n(Cl2)/mol |
| 0 |
0.5 |
0 |
0 |
| t1 |
0.45 |
||
| t2 |
0.1 |
||
| t3 |
0.4 |
(4)t1时刻,测得反应吸收的热量为a kJ。PCl3(g)与Cl2(g)反应的热化学反应方程式为。
(5)t2时:v正v逆(填“>”、“<”或“=”)。
(6)相同温度下,改为往容器中投入0.2 mol PCl5(g)、0.2 mol PCl3(g)、0.1 mol Cl2(g),到达平
衡前,PCl5的物质的量将(填“增大”、“减小”、“不变”)。
[化学一有机化学基础)芳香族化合物水杨酸、冬青油,、阿司匹林都是常用西药。它们的结构简式如下表:
(1)水杨酸分子中式量较大的含氧官能团名称是。
(2)水杨酸在浓硫酸催化作用下与乙酸酐(CH3C0)20反应生成阿司匹林,反应的化学方程。
(3)水杨酸在一定条件下可以聚合成高分子化合物聚水杨酸,聚水杨酸的结构简式为:。
(4)写出冬青油的一种同分异构体结构简式:异构体符合以下条件:
①芳香族化合物;
②苯环上一个氢原子被氯取代,有两种可能的产物;
③在足量氢氧化钠溶液中充分反应消耗等物质的量氢氧化钠。
(5)效更佳的长效缓释阿司匹林(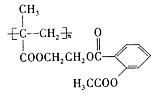 )在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为,反应类型为。
)在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为,反应类型为。