为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是______;
(2)当有1 mol I2生成时,有________ mol还原剂被氧化;
(3)当有1 mol氧化剂参与反应时,转移电子的数目为________。
(1)维生素C是一种水溶性的维生素,缺乏VC会使人患上 病。切取一片新鲜水果,向切面上滴加淀粉溶液和碘水,若出现 ,说明新鲜水果中含有VC,这是利用VC具有 (填“氧化”或“还原”)性质。
(2)经科学测定,人体平均含氧65%,含碳18%,含氢10%(以上均为质量分数),则三种元素中原子数目最多的是 (填元素符号)。
(3)某品牌抗酸药的主要成分有糖衣、氢氧化铝、淀粉。写出该抗酸药发挥功效时的离子方程式: 。
某有机物A化学式为CxHyOz,15 g A完全燃烧可生成22 g CO2和9 g H2O。试求:
(1)该有机物的最简式 ;
(2)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为 ;
(3)若A的相对分子质量为60且是易挥发有水果香味的液体,能发生水解反应,则其结构简式为______ ;
(4)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为 。
有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Y的原子结构示意图为 ,YW2的结构式为 。
(2)将X2、W2按下图所示通人某燃料电池中,其中,b电极的电极反应式为 。
若有16gW2参加反应,转移的电子是 NA。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为 。
由葡萄糖发酵可得乳酸,为研究乳酸的分子组成和结构,进行了下述实验:
(1)称取乳酸0.9 g,在某种状况下使其完全气化,相同状况下同体积的H2的质量为0.02 g,则乳酸的相对分子质量为 g。
(2)若将上述乳酸蒸气在氧气中燃烧只生成CO2和H2O(g),当全部被碱石灰吸收时,碱石灰的质量增加1.86 g;若将此产物通入过量石灰水中,则产生3.00 g白色沉淀。则乳酸的分子式为 。
(3)另取0.90 g乳酸,若与足量金属钠反应,生成H2 2240 mL(标准状况),若与足量碳酸氢钠反应,生成224 mL CO2(标准状况),则乳酸的结构简式可能为 或 。
(4)若葡萄糖发酵只生成乳酸,其反应的化学方程式为 。
为提高人体素质, 避免人体缺碘影响正常的生命活动,我国早已采取食盐加碘措施。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下图,回答下列问题: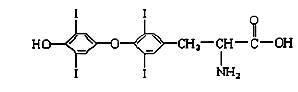
(1)“加碘食盐”中的碘元素以碘酸钾(KIO3 )的形式存在,KIO3中碘的化合价是 ,我们用稀盐酸和淀粉KI试纸可以检验食盐中碘酸钾的存在,反应的离子方程式为 ,实验现象是 。
(2)在“加碘食盐”包装袋上有“烹调时,待食品熟后加入碘盐”文字说明,由此可推测碘酸钾在受热时容易 。
(3)甲状腺素由________种元素组成,碘在人体中属于 (填“常量元素”或“微量元素”)