下列实验过程中,通常不需要使用玻璃棒的是 ( )
①用pH试纸测定Na 2CO3溶液的pH
②将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
③从氯酸钾和二氧化锰制取氧气的剩余物中提取KCl
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液
⑥用适量的蔗糖、浓硫酸和水在小烧杯中做浓硫酸的脱水性实验
⑦用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2
| A.②③⑦ | B.②⑤⑦ | C.②④⑤ | D.②④⑥ |
在无色的强酸性溶液中能大量共存的是
| A.Mg2+、Na+、Cl-、SO42- | B.K+、 Na+、 Cl-、 Cu2+ |
| C.K+ 、Na+、NO3-、CO32- | D.Na+、Ba2+、OH-、SO42- |
如图所示,A处通入氯气,关闭旋塞B时,C处红色布条无明显的变化,打开旋塞B时,C处红色布条逐渐褪色。由此作出的判断正确的是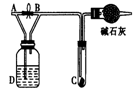
| A.D中不可能是浓硫酸 | B.D中可以是水 |
| C.通入的氯气中含有水蒸气 | D.D中可以是饱和食盐水 |
下列离子方程式书写正确的是
| A.盐酸与碳酸钡反应:CO32-+2H+=CO2↑+H2O |
| B.往硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-= BaSO4↓+Cu(OH)2↓ |
| C.稀硫酸溶液与氨水反应:H++OH-=H2O |
| D.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
用等体积的0.1 mol•L-1 BaCl2溶液,分别使相同体积的Fe2 (SO4 )3、Na2SO4、KAl(SO4)2三种溶液中的SO42-恰好完全沉淀,则三种硫酸盐溶液的物质的量浓度之比为
| A.3∶2∶3 | B.3∶1∶2 | C.2∶6∶3 | D.1∶1∶1 |
下列叙述正确的是
| A.标准状况下,l mol任何物质的体积均为22.4 L |
| B.CH4的摩尔质量为16 g |
| C.1mol H2O的质量为18 g•mol-1 |
| D.3.01×l023个SO2分子的质量为32 g |