芳香族化合物A有如下图的转化关系: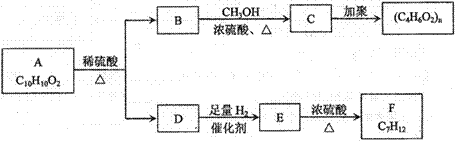
已知D能与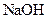 溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请回答下列问题:
溶液反应,E转化为F时,产物只有一种结构,且能使溴的四氯化碳溶液褪色。请回答下列问题:
(1)B的分子式是_____________
(2)A、F的结构简式 A ___________ F __________
(3)写出B→C、E→F的化学反应方程式,并注明反应类型
B→C:_____________________________________________( )
E→F:_____________________________________________( )
(4)符合下列3个条件的A的同分异构体有多种
①苯环含有对二取代结构 ②遇FeCl3溶液不变色
③能发生银镜反应
请写出其中任意一种的结构简式________________________________________
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
①写出制取高铁酸钠的化学方程式:;
②在制取高铁酸钠的反应中元素被氧化;
③高铁酸钠之所以有净水作用,除杀菌外,另一个原因是。
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液。将发生一系列变化。已知,NH4+与AlO2—在水溶液中不能大量共存,会发生如下反应:NH4++A1O2—+H2O=Al(OH)3↓+ NH3↑
试回答:
①硫酸铝铵在水溶液中的电离方程式为;
②在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:a溶液中出现白色沉淀;b有刺激性气体逸出;c白色沉淀量逐渐增多;d白色沉淀完全消失;e白色沉淀逐渐减少。
请回答各种现象由先到后出现的顺序是(用序号回答):。
③并在下图中画出氢氧化钠的加入体积与沉淀量的关系.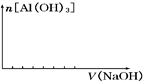
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| 卤素 |
氰 |
硫氰 |
① |
|
| “单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
| 酸 |
HX |
HCN |
② |
HOCN |
| 盐 |
KX |
KCN |
KSCN |
③ |
(1)在表中①②③空格处应分别填写_______、、_______。
(2)完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为:。
②已知阴离子的还原性强弱为:Cl-<Br-<CN—<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
写出下列过程的离子方程式。
⑴除去铁粉中混有的铝粉
⑵除去CO2中混有的HCl
⑶NaAlO2溶液中通入少量CO2
⑷1 mol/L 100 mL FeBr2溶液中通入2.24 L Cl2(标准状况)
为验证卤素单质氧化性的相对强弱,某小组用右图所示装置进行试验(夹持仪器已略去,气密性已检验)。试验过程: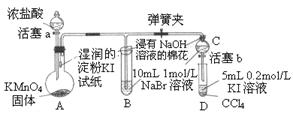
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕色时,关闭活塞a。
IV.……
试回答下列问题:
(1)A中产生 色气体,其结构式是 。
(2)能使湿润的淀粉—KI试纸变蓝的气体是 。
(a) Cl2 (b) N2O4 (c) I2蒸气 (d) SO2 (e) O3 (f) CO2
(3)滴加浓盐酸前,分液漏斗首先要 。
(4)过程III实验目的是 。
(5)A中产生氯气的离子方程式为 。
(6)B中浸有NaOH溶液的棉花作用是 ,写出反应的离子方程式 。
美国科学家最近研究发现阿司匹林可降低患哮喘的风险。这项研究成果发表在《美国呼吸系统疾病护理医学杂志》上。阿司匹林(乙酰水杨酸)的合成原理是: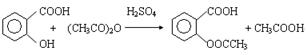
试回答下列问题:
(1)该反应的类型是 。
(2)反应中的4种有机物,遇FeCl3溶液显紫色的是(填名称) 。
(3)1 mol阿司匹林最多可与 mol NaOH溶液反应。
(4)同时符合下列3个条件的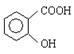 的同分异构体有 种。
的同分异构体有 种。
①遇FeCl3溶液显紫色 ②苯环上含有两个取代基