(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
①写出制取高铁酸钠的化学方程式: ;
②在制取高铁酸钠的反应中 元素被氧化;
③高铁酸钠之所以有净水作用,除杀菌外,另一个原因是 。
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液。将发生一系列变化。已知,NH4+与AlO2—在水溶液中不能大量共存,会发生如下反应:NH4++A1O2—+H2O=Al(OH)3↓+ NH3↑
试回答:
①硫酸铝铵在水溶液中的电离方程式为 ;
②在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:a溶液中出现白色沉淀;b有刺激性气体逸出;c白色沉淀量逐渐增多;d白色沉淀完全消失;e白色沉淀逐渐减少。
请回答各种现象由先到后出现的顺序是(用序号回答): 。
③并在下图中画出氢氧化钠的加入体积与沉淀量的关系.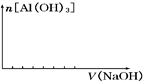
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 。氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是 ;1 mol O22+中含有的π键数目为 。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。
Cr3+基态核外电子排布式为 。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为 。
(5)下列物质的分子与O3分子的结构最相似的是。
A. H2O B . CO2C. SO2 D. BeCl2
. CO2C. SO2 D. BeCl2
(6)O3分子是否为极性分子
(15分)
工业上以磷肥生产形成的副产物石膏(CaSO4·2H2O)与焦炭为原料可生产硫酸,同时可以得到硫酸钾肥料和氯化钙水合物储热材料。以下是有关的工艺流程示意图。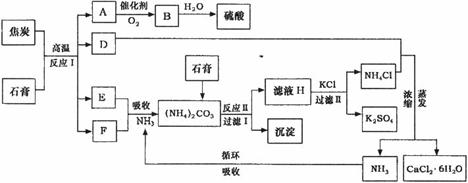
试回答:
(1)写出方程式:反应Ⅰ___________________________________,
(2)写出方程式:反应Ⅱ______________________________________。
(3)请根据下表和化学平衡知识,分析工业上制硫酸中SO2的催化氧化的适宜条件是
____________________________________。
表Ⅰ:
 压强 / M Pa 压强 / M Pa转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
(4)检验滤液H中含有CO 的方法是___________________________________。
的方法是___________________________________。
(5)氯化钙结晶水合物(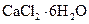 )是目前常用的无机储热材料,选择的依据是___________
)是目前常用的无机储热材料,选择的依据是___________ (填序号)。
(填序号)。
a.熔点较低(29℃熔化) b.能导电 c.易溶于水 d.无毒
物质A、B、C、D为中学常见单质,其组成元素的原子序数依次减小,且其中只有三种是短周期元素,B为黄绿色气体。试根据下图中物质的相互转化关系回答下列问题。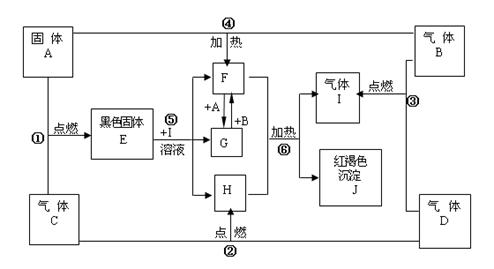
(1)A是_________
(2)在 的转化中,A的作用是;在①~⑥的反应中,不属于氧化
的转化中,A的作用是;在①~⑥的反应中,不属于氧化 还原反应的是。(多填或少填无分)
还原反应的是。(多填或少填无分)
(3)写出A在高温下与H反应的化学反应方程式并标出电子转移的方向和数目
。
(4)写出反应⑥的化学反应方程式 。
(5)已知在101 kPa 条件下,2 mol D完全燃烧生成液态生成物放出571.6 kJ热量;请书写表示D燃烧热的热化学方程式:
(14分)D、E为中学化学常见的金属单质,在一定条件下C、D间能发生反应.各物质转化关系如下图: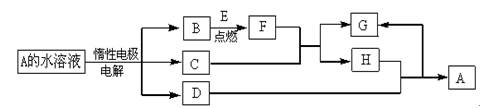
⑴B的同素异形体的名称为:_____________;H的化学式为:_____________.
⑵写出D与H反应的离子方程式_____________.
⑶用惰性电极电解A 溶液的阳极反应式为:_____________.
⑷检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________.
a.氯水和KSCN溶液 b.氢氧化钠溶液 c.酸性KMnO4溶液
⑸用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8 g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH.则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________.
(15分)
已知G是合成某高分子化合物的原料,只含C、H、O三种元素,5.9g物质G能与1mol/LNaOH的溶液100mL恰好完全反应,0.1mol物质G与足量金属钠反应在标准状况下生成2.24L氢气,分子结构中含有一个甲基,A的分子式为C8H13O2Br,有机物A、B、C、D、E、F、G之间的相互转化关系如图所示: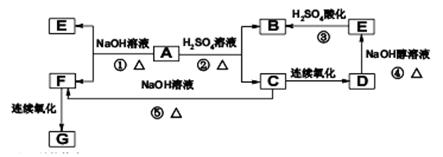
⑴写出C的结构简式:.
⑵A中官能团名称是:.
⑶B的同分异构体中属于酯的有多种,任写其中三种属于酯类的结构简式:
,,.
⑷写出D→E化学反应方程式:.
⑸写出反应①化学反应方程式:
⑹写出由F和G 在一定条件下合成高分子化合物的化学反应方程式:
.