(10分)(1)如图所示,将CL2依次通过盛有干燥有色布条的广□瓶和盛有潮湿有色布条的广口瓶,可观察到灼现象是 。
(2)为防止 Cl2,尾气污染空气,可用氢氧化钠溶液吸收多余的Cl2,原理是 (用化学方程式表示 )
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是 (填化学式),
长期露置于空气中的漂白粉,加稀盐酸后产生的气体是 (填字母代号)。
A.O2 B.Cl2 C.CO2 D.HCIO
(3)2004年4月15日至16日,位于重厌市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
A.NaOH B.NaCI C.KBr D.Na2CO3
(12分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离: H2A H++HA-, HA-
H++HA-, HA- H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A. 0.01 mol·L-1的H2A溶液
B. 0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液,据此,填写下列空白(填代号):
(1)c(H+)最大的是,最小的是。
(2)c(H2A)最大的是,最小的是。
(3)c(A2-)最大的是,最小的是。
(4分)氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436kJ/mol,氧气分子O=O键能为498 kJ/mol,则水分子中O-H键的键能为kJ/mol。若1 g水蒸气转化成液态水时放热2.5 kJ,则反应H2(g) + 1/2O2(g) ==H2O(l)的△H=kJ/mol
已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=。
(3)能判断反应③已达平衡状态的是。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式。据此关系式及上表数据,也能推断出反应③是(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________(填编号)。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
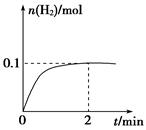
①0~2 min内的平均反应速率v(HI)=。该温度下,H2(g)+I2(g) 
2HI(g)的平衡常数K=。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡移动(填“向左”“向右”或“不”);若加入少量下列试剂中的,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的 能量转化率为________。
能量转化率为________。
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g) + 3H2(g) CH3OH(g) +H2O(g)△H="-49.0" kJ·mol-1。
CH3OH(g) +H2O(g)△H="-49.0" kJ·mol-1。
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)
回答下列问题:
(1)该反应在0~8 min内CO2的平均反应速率是mol/(L?min)。
(2)该反应的平衡常数K=。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比曲线Ⅰ改变的条件可能是,曲线Ⅱ改变的条件可能是。若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.有效碰撞理论可指导怎样提高原料的转化率 |
| C.勒夏特列原理可指导怎样使用有限原料多出产品 |
| D.催化剂的使用是提高产率的有效方法 |
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益