(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
②若反应温度不变,反应物的起始浓度分别为:c(M)="4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a= ;
(2)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比_______(填“大于”、“小于”或“等于”)10,说明理由_____________________________。
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①H2SO4溶液: HSO4-  H++SO42- H++SO42- |
②NaHSO4溶液: HSO4-  H++SO42- H++SO42- |
③盐酸 HCl=H++Cl |
| 10% |
29% |
100% |
25℃时,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序
是 (填序号)
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是 (填序号)
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是________________ 。
(12分)某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、镁、铝各0.2mol分别投入到100mL的1mol/L盐酸中,试预测实验结果:
______与盐酸反应最剧烈,___与盐酸反应的速度最慢;_____与盐酸反应产生的气体体积最多(同状况下)。
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律:
(2)仪器A的名称为_____,干燥管D的作用为_________。
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____的现象,即可证明。有的同学认为该实验设计不够严密,则应在B、C两装置间添加装有________溶液的洗气瓶。
(13分)(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀盐酸。
①B中Fe极的电极反应式为。
②C中总反应化学方程式为。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序。
(2)如图是甲醇燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”),该极的电极反应是:_____________。
②电池工作一段时间后电解质溶液的碱性________(填“增大”、“减小”或“不变”)。
下表是元素周期表的短周期部分,表中字母分别表示一种元素。
| a |
|||||||
| d |
f |
g |
|||||
| b |
c |
e |
h |
请回答下列问题:
(1)g与a可形成化合物a2g,试写出它的结构式,常温下,将b的单质投入a2g中,发生反应的离子方程式为。
(2)d、f、e三种元素最高价氧化物对应的水化物的酸性由弱到强的顺序为(用化学式表示)。
(3)b的最高价氧化物的水化物与单质c反应的离子方程式,该反应(填“能”或“不能”)作为设计原电池的反应原理。
已知I、II反应在一定条件节焓变及平衡常数如下:
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g) S2(g)+4H2O(g)的△H
S2(g)+4H2O(g)的△H
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1L恒容容器中加入1.8mol H2、1.2mol S2, 10min时反应达到平衡。测得10min V(H2S)=0.08 mol·L-1·min-l,则该条件下的平衡常数为L·mo1-l,若此时再向容器中充H2、S2、H2S各0.8mol,则平衡移动方向为(填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1),在1L恒容容器中也加入1.8mol H2、1.2mol S2,建立平衡时测得S2的转化率为25%,据此判断△H10(填“>”或“<”),与T1时相比,平衡常数K1(填“增大”、“减小”或“不变”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是(写出主要反应的离子方程式),该溶液中,[Na+]2[ SO ]+ [HSO
]+ [HSO ](填“>”、“<”或“=”)。
](填“>”、“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO 、SO
、SO 物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO
物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO 的水解平衡常数=mol·L-1.
的水解平衡常数=mol·L-1.
研究证明,CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下: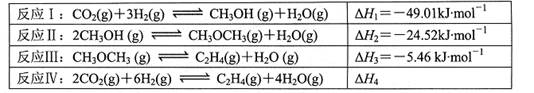
反应开始时在0.lMPa下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的物质的量百分数如图1所示: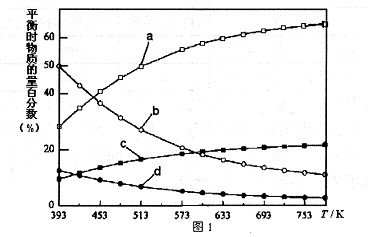
请回答下列问题:
(1)△H4=kJ-mol-1。
(2)可以判断该反应已经达到平衡的是。
A.v(CO2)="2" v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为 (写化学式),判断依据是 。
(4)为提高CO2的平衡转化率,可以采取的措施是。
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值。