某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下:
请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
(填字母)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(CO)=c(CH3OH) d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式: 。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是 。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为 。
(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛 g(精确到0.1,下同),甲醇厂CO的转化率为 。
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为。
(2)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)。
(3)若D是一种常见的温室气体,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,固体C受热分解可得固体B,该反应的化学方程式是。
(4)若D为氯碱工业的主要产品,B具有两性,则B转化为C的离子方程式为。
(5)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则元素D在周期表中的位
置是,B分子的结构式为。
如下图装置所示,是用氢氧燃料电池B进行的某电解实验: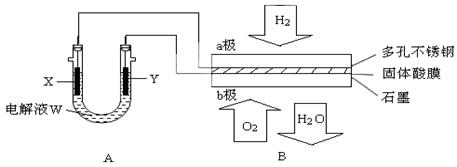
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:
Li2NH+H2=LiNH2+LiH ,则下列说法中正确的是。
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H+的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |
(2)在电池B工作时:
① 若用固体Ca(HSO4)2为电解质传递H+,则电子由 极流出,H+向极移动。(填“a”或“b ”)
② b极上的电极反应式为:
③ 外电路中,每转移0.1 mol电子,在a极消耗L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
① 电解池中X极上的电极反应式是。在X极这边观察到的现象是。
② 检验Y电极上反应产物的方法是。
③ 若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是。
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+O2 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速度。该反应K值将。压强将。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是。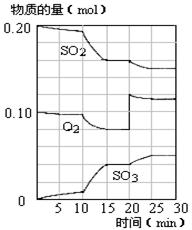
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是(填写编号)。
a.增加SO3的物质的量 b.缩小容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是。
对羟基苯甲酸乙酯又称尼泊金乙酯,是一种常见的食品添加剂及防腐剂,其生产过程如下:(反应条件未全部注明)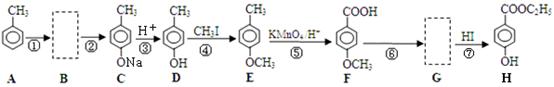
回答下列问题:
(1)D所含官能团的名称。
(2)有机物G的结构简式。
(3)反应④的反应类型是。
(4)反应⑥的试剂和条件是。
a.乙醇、浓H2SO4 b.乙酸、浓H2SO4
c.乙醇、稀H2SO4 d.乙酸、稀H2SO4
(5)下列四种物质不与H反应的是。
a.FeCl3溶液 b.NaOH溶液 c.NaHCO3溶液 d.浓Br2水
(6)反应②的化学方程式是
(7)D有多种同分异构体,写出一个与D不同类且含苯环的结构简式:。
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 |
操作 |
现象 |
| I |
向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 |
溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ + SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 |
操作 |
现象 |
| II |
用激光笔照射步骤I中的红褐色溶液 |
出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 |
操作 |
现象 |
| III |
向1 mol•L-1的FeCl3溶液中通入一定量的SO2 |
溶液由黄色变为红褐色 |
| IV |
用激光笔照射步骤III中的红褐色溶液 |
没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液b.KSCN溶液c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因:。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。