如图为电解装置,X、Y为电极材料,a为电解质溶液。
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,电解一段时间后:
X电极附近可观察到的实验现象是 ;
写出Y电极的电极反应式 。
(2)若要实现Cu +H2SO4=CuSO4+H2↑,
则Y电极材料是 ;
写出X电极的电极反应式 。
(3)若要利用该装置在铁制品表面镀上一层银,则a为 ,反应前两电极的质量相等,反应后电极质量相差2.16g,则该过程理论上通过电流表的电子数为 。
(4)若X、Y均为惰性电极,a为NaOH溶液,电解一段时间后,溶液的pH (填“增大”“不变”“减小”),若要使溶液恢复原来的状态,可往溶液中加入 。
硝基苯甲酸乙酯在OH — 存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
(1)列式计算该反应在120~180s与330~530s区间的平均反应速率__________,__________;比较两者大小可得出的结论是______________________________。
(2)列式计算该温度下反应的平衡常数____________________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,可以采取的措施有_______________(要求写出两条)。
(4)硝基苯甲酸乙酯有种,其中苯环上的一氯代物最少的结构简式为。
氮化硅(Si3N4)是一种优良的高温结构陶瓷,在航天航空、汽车发动机、机械等领域有着广泛的用途。工业上有多种方法来制备氮化硅,常见的方法有:
(1)在1 300-l 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为_________。
(2)在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl。
①已知:25℃,101 kPa条件下的热化学方程式:
3Si(s)+2N2(g)=Si3N4(s) △H= -750.2kJ/mol
Si(s)+2Cl2(g)=SiCl4(g) △H="-609.6" kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H="--184.6" kJ/mol
四氯化硅气体与氮气、氢气反应的热化学方程式为____________________。
②工业上制取高纯硅和四氯化硅的生产流程如下: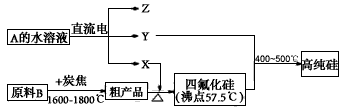
已知:X,高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
上述生产流程中电解A的水溶液时,阳极材料能否用Cu?________(填“能”或“不能”)。写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式。阳极:;阴极:。
(3)由石英砂合成氮化硅粉末的路线图如下所示
(把图中的①·⑤改为I-V)
①石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因:。
②图示I-V的变化中,属于氧化还原反应的是。
③SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学方程式为___________________。
④在反应IV中四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式);在反应V中Si(NH2)4受热分解,分解后的另一种产物的分子式为。
[化学—选修3物质结构与性质】(巧分)已知A, B、C、D, E, F为元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位。试回答下列问题:
(l)F元素的价层电子排布式为。
(2)关于B2A2的下列说法中正确的是(填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键构形成的非极性分子
③每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
④B2A2分子中的A-B键属于 键
键
(3)B,C,D三种元素第一电离能按由大到小的顺序排列为(用元素符号表示) B、C、D三种元素中与BD2互为等电子体的分子式为(用元素符号表示)
(4)A2E分子中心原子的杂化类型为_____。比较A2D与A2E分子的沸点,其中沸点较高的原因为。元素D可形成两种同素异形体,其中在水中溶解度更大的是(填分子式)。
(5) F单质的晶体在不同温度下有两种堆积方式,信息如下:
则方式I与方式II中F原子配位数之比为,晶体密度之比为。
[化学一选修2化学与技术」磷单质及其化合物有广泛应用。
(1)磷酸二氢钙,广泛用于动物的饲料添加剂。目前其制备的新工艺方法有:石灰法:用石灰石中和磷酸,控制终点PH为3.2,即得磷酸二氢钙。请写出该反应的化学方程式;若有1x103kg石灰石最多能生产kg磷酸二氢钙。
(2)用石英、焦炭与磷灰石[主要成分Ca5(P04)3F]在高温下制备黄磷(P4)的化学方程式为: 在此反应中,副产物矿渣可用来。
在此反应中,副产物矿渣可用来。
(3)三聚磷酸可视为三个磷酸分子(磷酸结构简式如图 )之间脱去两个水分子的产物,其结构简式为。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为。
)之间脱去两个水分子的产物,其结构简式为。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为。
(4)次磷酸钠(NaH2P02)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2P02在酸性条件下发生下述反应:请配平该离子方程式。
(5)H3P02可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式。
②分析产品室可得到H3P02的原因。
(15分)“优先反应思想”是一条重要的化学学科思想。根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄。你认为使溶液变黄的微粒其符号是用实验证明你的观点,简述实验操作及现象。
(2)用惰性电极电解由等物质的量的NaBr,KI, NaCl组成的混合溶液,阳极首先发生的电极反应式是。
(3)己知常温下一些电解质的相关数据见下表:
①向等物质的量浓度的Na2C03, CH3COONa, NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是。
②向浓度均为0.010 mol/L的NaCl, Na2Cr04组成的混合溶液中逐滴加入浓度为0.010 mol-L -1AgN03溶液,首先生成的沉淀其化学式为。
(4)分别向四份各100 ML,浓度均为2 mo1-L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为。
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示)。