工业制硝酸的主要反应是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。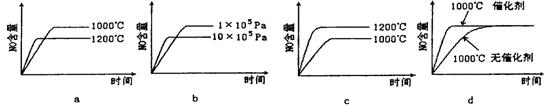
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是_________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。
(10分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。请填写以下空白: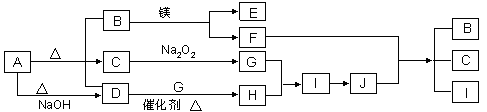
(1)A的化学式B的电子式。
(2)写出下列反应的化学方程式:
D+G→ H,
F+J → B + C + I。
(3)写出A+NaOH→D的离子方程式。
. 金晶体是面心立方体,立方体的每个面上5个金原子紧密堆砌(如图3,其余各面省略),金原子半径为A cm,求: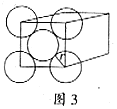
(1)金晶体中最小的一个立方体含有___________个金原子。
(2)金的密度为___________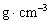 。(用带A计算式表示)
。(用带A计算式表示)
(3)金原子空间占有率为___________。(Au的相对原子质量为197,
用带A计算式表示)
原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是:,该主族元素的气态氢化物中,沸点最低的是(填化学式)。
(2)根据等电子原理分析,BC2+ 中B原子的轨道杂化类型是。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为;;
(6)E的基态原子有种形状不同的原子轨道;E2+ 的价电子排布式为;下
图(填甲、乙或丙)表示的是E晶体中微粒的堆积方式。


甲乙丙
(共14分)若A~E均为单官能团有机物,它们之间有如下转化关系: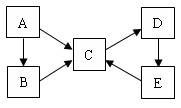
烯烃A的密度是相同条件下氧气密度的1.75倍;结构分析表明A没有顺反异构体;A的核磁共振氢谱共有两组峰,峰面积之比为1:3。B在一定条件下能与NaOH反应;E是一种有水果香气的无色液体,广泛存在于香蕉、葡萄、菠萝等水果以及啤酒花中,是一种重要的香料。
(1)D的结构简式为____________________
(2)B在一定条件下变为A的化学方程式为____________________
(3)A→C的反应类型____________________
(4) A与X互为同分异构体,它们具有相同官能团。X经过下述变化可以生成J,J能脱水缩聚成高分子化合物K。
①化合物J中官能团的名称是____________
②写出结构简式:I________________;
③由J生成K的化学方程式为____________________
④F有多种同分异构体,其中仅含有一个手性碳的结构是。
(共10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。依照该规律,请判断下列反应不能成立的是______(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HClO B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa→NaHCO3+C6H5OH D.CO2 +H2O +2C6H5ONa→Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是(填编号),其pH值约为_______(填数值)。
①HCN②CH3COOH③HClO4④HClO⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液;②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
请根据上述反应,总结出复分解反应发生的另一规律。根据这结论,现将Na2S和AgI固体混合搅拌,则反应的离子方程式 。