用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
| |
NaOH起始读数 |
NaOH终点读数 |
| 第一次 |
0.40mL |
18.50mL |
| 第二次 |
1.30mL |
18.05mL |
| 第三次 |
3.10mL |
21.20mL |
(1)达到滴定终点的时溶液颜色的变化为  色到 色;
色到 色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为 ;
(3)以下操作造成测定结果偏高的原因可能是 。
| A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.未用标准液润洗碱式滴定管 |
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是;
(2)烧杯间填满碎纸条的作用是;
(3)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”“不相等”),所求中和热(填“相等”“不相等”);
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会.(均填“偏大”“偏小”“无影响”)
实验室用需配制250mL0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的Na2CO3溶液
| 实际应称Na2CO3质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _____;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是
溶液注入容量瓶前需恢复到室温,这是因为_______________________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作;若加蒸馏水时不慎超过了刻度;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
发生装置 |
| ① |
制氧气 |
  |
|
| ② |
制氨气 |
 |
|
| ③ |
制氯气 |
 |
(1)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。
(2)上述气体中,从反应中有无电子转移的角度看,明显不同于其他气体的是,写出实验室制取该气体的化学方程式.
(3)若用上述制备 的装置制备
的装置制备 ,应选择的试剂为.
,应选择的试剂为.
(4)制备 需用
需用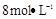 的盐酸1OOml,现用
的盐酸1OOml,现用 的盐酸来配制。
的盐酸来配制。
①需要用量筒量取 的盐酸的体积为mL;
的盐酸的体积为mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号)。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.lOmL量筒 F.胶头滴管 G.lOOmL烧杯 H.lOOmL容量瓶
③下列实验操作中,不正确的是(填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
某小组的同学对放置已久的过氧化钠的成份进行探究,请回答下列问题:
(1)反应 2Na2O2+2H2O=4NaOH+O2↑的还原剂是(写化学式);
反应2Na2O2+2CO2=2Na2CO3+O2↑中,每生成1molO2则转移了mol电子。
(2)进行探究:
①提出假设。假设1:全部是Na2O2假设2:全部是Na2CO3
假设3:
②设计方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:蒸馏水、1moL L-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。
L-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
步骤1:取少量固体样品于试管中,滴加足量1moL L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口。 L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口。 |
若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则 |
| 步骤2: |
|
| 步骤3: |
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
①用接口字母标出各仪器连接的顺序量筒在实验中的作用是
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
⑤配平下列方程式: