运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)
2SO2(g) +O2(g)
+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);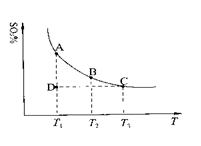
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,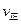
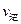 (填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,
请写出工业合成氨的热化学反应方程式: 。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白 色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时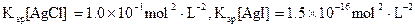 )
)
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般可采用下列反应合成甲醇:
CO(g) + 2H2(g)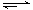 CH3OH(g) ΔH
CH3OH(g) ΔH
①下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.04 |
0.25 |
0.012 |
由表中数据判断ΔH 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,5min该反应达到平衡,测得c(CO)= 0.2 mol/L,则用H2表示的5min内该反应的反应速率为,此时的温度为(从上表中选择)。
③300℃时,向2L的密闭容器中投入CH3OH(g)发生反应I,达平衡时CH3OH(g)的分解率是50%,求起始投入CH3OH(g)的物质的量mol。
(2)在压强为0.1 MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可增加甲醇产率的是。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
(1)则25℃时水的电离平衡曲线应为(填“A”或“B”)。
(2)95℃时水的离子积KW=。
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为。
(4)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是。
(5)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:。
现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中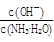 (增大、减小、不变)
(增大、减小、不变)
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
所得溶液的pH7(填“>”“<”或“=”)。
(3)若向该氨水中加入氢氧化钠固体,则该电离平衡向方向移动(分子化、离子化),电离平衡常数。(增大、减小或不变)
一定温度下在10L容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生反应。
(1)生成了molSO3,SO2的转化率为。
(2)平衡时容器内气体的总物质的量为mol。
(3)平衡时SO2的浓度是mol/L。
下列材料后回答问题
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+ Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂;
Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂;
(2)“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中具有性,人体缺少铁元素可能会患,
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐.离子方程式为 ___ __。