如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):2X(?)+ Y(?) a Z(g),此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
a Z(g),此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ>Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
以下化学用语正确的是
| A.明矾的化学式KAlSO4·12H2O | B.氯化钠的电子式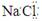 |
| C.乙烯的结构简式CH2CH2 | D.乙酸的分子式C2H4O2 |
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
| A.金属性:Y>Z | B.氢化物的稳定性:X>W |
| C.离子的还原性:X>W | D.原子及离子半径:Z>Y>X |
下列说法中正确的是( )
| A.在共价化合物中也可能含有离子键 | B.非金属之间形成的化学键一定是共价键 |
| C.含有共价键的化合物一定是共价化合物 | D.含有离子键的化合物一定是离子化合物 |
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个。则这三种元素所组成的化合物的分子式不可能是( )
| A. X2YZ4 | B. XYZ3 | C. X3YZ4 | D.X4Y2Z7 |
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A.质子数:c > d | B.还原性:Y2-> Z- |
| C.氢化物的稳定性:H2Y > HZ | D.原子半径:X < W |