(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。 Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)  2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。 (2)在一定温度和压强下,已知:
(2)在一定温度和压强下,已知:
O2 (g) = O2+ (g) + e-; H1=" 1175.7" kJ/mol
H1=" 1175.7" kJ/mol PtF6 (g) + e- = PtF6- (g);
PtF6 (g) + e- = PtF6- (g); H2=" ―771.1" kJ/mol
H2=" ―771.1" kJ/mol O2PtF6 (s) = O2+ (g) + PtF6- (g);
O2PtF6 (s) = O2+ (g) + PtF6- (g); H3=" 482.2" kJ/mol
H3=" 482.2" kJ/mol 则反应O2 (g) + PtF6 (g) = O2PtF6(s);
则反应O2 (g) + PtF6 (g) = O2PtF6(s); H="_____________" kJ/mol。
H="_____________" kJ/mol。 Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)有关A、B、C三种物质的说法正确的是(填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为。
(3)0.5molB与足量的溴水充分反应,消耗mol单质溴。
(4)已知: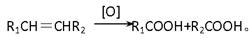 有机物C9H8O发生如下反应:
有机物C9H8O发生如下反应:
则C9H8O的结构简式为。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。
工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)煤的气化的主要化学反应方程式为:_____________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g) CH3OH(g) ΔH =-90.8 kJ·mol-1
CH3OH(g) ΔH =-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH=-23.5 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH=-41.3 kJ·mol-1
CO2(g)+ H2(g) ΔH=-41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的ΔH= ___________;
CH3OCH3(g)+ CO2(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= _________;该时间内反应速率v(CH3OH)= __________。
元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为。(表1)
| 氢化物 |
A |
B |
HF |
D |
E |
| 沸点/℃ |
1317 |
100 |
19.5 |
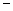 33.35 33.35 |
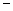 164 164 |
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为。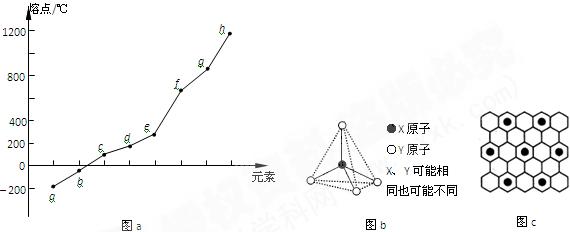
在①渗析②盐析③聚沉④溶胶⑤凝胶⑥布朗运动⑦电泳⑧丁达尔效应⑨中和⑩水解中选择适当的词语填入下列每小题的空格中(填编号)。
(1)用平行可见光照射肥皂水,从侧面可以见到光带。这种现象称为。
(2)冷却热的肥皂水并使之全部固化后的物质叫。
(3)在肥皂水中加入酚酞变成红色,说明高级脂肪酸根离子发生了。
(4)在Fe(OH)3胶体中加入(NH4)2SO4,产生红褐色沉淀,这种现象叫做。
(5)用半透膜把制取的Fe(OH)3胶体中含有的NaCl分离出去的方法叫做。
现有Cu2 +、Cl―、Na+、SO42―、Zn2+两两组成的电解质溶液若干种,可选用铜电极、铂电极、锌电极进行电解实验。
+、Cl―、Na+、SO42―、Zn2+两两组成的电解质溶液若干种,可选用铜电极、铂电极、锌电极进行电解实验。
(1)以铜为阳极电解_________或____________溶液,均可得到氢氧化物沉淀。
(2)要使电解过程中溶质的组成和质量不变,而溶液浓度增大,又无浑浊,应以
__________为阳极电解_____________溶液,化学方程式为_______________________。
(3)要使电解过程中溶液浓度改变,而溶剂 质量不变,应以铂电极为阳极电解___________溶液,或以_________为阳极电解________溶液,前者反应的化学方程式是_________________________。
质量不变,应以铂电极为阳极电解___________溶液,或以_________为阳极电解________溶液,前者反应的化学方程式是_________________________。
(4)使反应Cu+2H2O==Cu(OH)2 ↓+H2 ↑ 得以进行而不发生其它反应,可选用______________为阳极电解__________或____________溶液
(5)以铜为阳极电解ZnSO4溶液,阴极上一般有___________逸出,在________极区首先会有__________色沉淀,电解时间较长时,会有______色沉淀出现。