(8分)在FeCl3溶液中
(1)氯化铁水解的离子方程式为____________________________________________。
(2)在配制FeCl3溶液时,防止浑浊,应加 入________________________________。
入________________________________。
(3)在FeCl3溶液中加入一定量Na2CO3溶液,产生的现象是________________________,有关反应的离子方程式为_______________________________________________ _______。
_______。
科学家一直致力于“人工固氮”的新方法研究。
(1)最新“人工固氮”的研究报道:常温常压.光照条件下,N2在催化剂表面与水发生反应:2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g)+ Q
4NH3 (g)+3O2 (g)+ Q
已知该反应的平衡常数K与温度的关系如右图,则此反应的 Q 0 (填“>”“<”或“=”)。
(2)常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,(选填编号)。
A.容器中气体的平均分子量不随时间而变化B.v(N2)/ v(O2)=2:3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
(3)将反应生成的混合气体通入水中即可得氨水。用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而增大的是 (填字母标号)。
A.c(H+)×c(NH3·H2O)/c(OH-) B.c(NH4+)×c(OH-)/c(NH3·H2O)
C.c(H+)·c(OH-) D.
(4)常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,请在右图中画出正(v正).逆(v逆)反应速率随时间t变化的示意图。
某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3.C.N2.AlN.CO
(1)请将AlN之外的反应物与生成物分别填入以下空格内,配平,并标出电子转移的方向和数目
(2)若反应中共转移3.01 ×1023个电子,则该反应产生气体的体积为:(标准状况下)
(3)氮化铝也能由氯化铝与氨气经气相反应制得:AlCl3+NH3 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
A.前一方法中的 Al2O3.C.N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.前一方法中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
硼.碳.氮.硅元素的单质及其化合物是构成自然界的重要物质。
(1)硼元素原子核外电子排布式_________________。氮元素原子的核外电子中,未成对电子数与成对电子数之比为 。
(2)甲烷是最简单的有机物,实验室可通讨下列反应制取: ,反应涉及到的物质中,X属于 晶体(填晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
(3)甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2 H2O → 8Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断非金属性Si比 H (填“强”.“弱”或“无法比较”)
(4)石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
某草酸盐晶体KxFey(C2O4)z•wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| 120℃ |
300℃ |
480℃ |
|
| 化学式 |
KxFey(C2O4)z |
KxFeyO(C2O4)z-1 |
KxFeyO2(C2O4)z-2 |
| 质量 |
4.370g |
3.650g |
2.930 g |
加热到300℃以上时,还生成了一种不常见的碳的氧化物气体(用R表示);
② 另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800g。
(1)计算得出草酸盐晶体中结晶水的质量分数为(保留三位小数);
(2)R的化学式为;
(3)草酸盐晶体的摩尔质量为;
(4)试通过计算,确定草酸盐晶体的化学式。
那格列奈是一种新型的餐时血糖调节剂,适用于Ⅱ型糖尿病。其合成路线如下: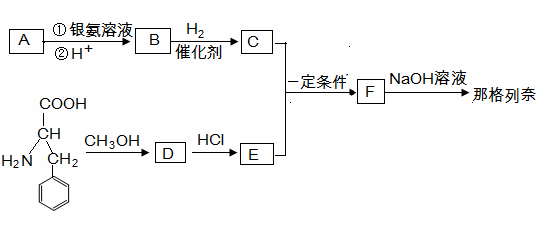
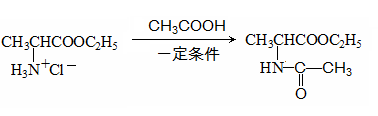
已知: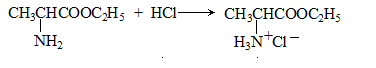
(1)有机物A蒸气密度是相同状态下氢气密度的74倍,A分子中碳元素的质量分数是氢元素质量分数的10倍,A的1个分子中含有1个氧原子, A中含氧官能团的名称为;A的分子式为。
(2)已知A的结构满足以下条件:① 含有苯环,苯环上有两个取代基;
② 苯环上的一溴取代物只有两种;
③ 取代基上有三种不同的氢原子。
写出A的结构简式:
(3)写出流程中制取D的化学方程式:
(4)由F制取那格列奈的反应类型是。
(5)1 mol B与3 mol H2加成得到C,写出C和E制取F的化学方程式:
(6)物质B分子的取代基上一个氢原子被1个溴原子取代后,再消去1个HBr得到有机物G,下列关于G的说法正确的是(选填字母编号)。
a.能使酸性高锰酸钾溶液褪色 b.分子中有7种不同的氢原子
c.能与碳酸氢钠反应放出气体 d.B经上述过程可以得到两种同分异构体