硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。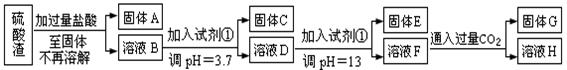
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
| A.氢氧化钠 | B.氧化铝 | C.氨水 |
D.水 |
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)H中溶质的化学式: ;
(5)计算溶液F中c(Mg2+)= ( 25℃时,氢氧化镁的Ksp=5.6×10-12)
下图所示是中学化学里常见纯净物A—L间的反应关系,其中A、H、E、F为单质且E、F为气体,B在常温下是无色液体,C是淡黄色固体,L是红褐色固体。
请根据图示判断并回答下列问题:
(1)单质A中所含元素在周期表中的位置是;
(2)反应③的化学方程式为;
(3)反应④的离子方程式为;
(4)反应⑧的离子方程式为;
(5)反应②发生过程中,当有3.01×1024个电子发生转移时,电解消耗物质B的质量为g,同时阴极生成的气体的体积为L(换算为标准状况下的体积)。
四种短周期元素A、B、C、D,原子序数依次增大,结合下列信息:
(1)A的最高价氧化物对应的水化物E与其气态氢化物F反应,得到离子化合物G。
(2)B的焰色应呈黄色。
(3)C在同周期主族元素形成的简单离子中,离子半径最小.
(4)D最高正价与最低负价之和为零.
回答下列问题:
(1)写出D在元素周期表中的位置:
(2)写出化合物F的电子式 ,结构式
(3)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是(填元素符号)
(4)下列可作为比较元素B和C金属性强弱的依据是( 填序号)
a.自然界中的含量b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
A的一种氢化物HA3可用于有机合成,其酸性与醋酸相似,体积和浓度均相等的HA3与B的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是混合后溶液中离子浓度由大到小的顺序是
某化学兴趣小组的同学为进行物质性质的探究,用维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利滴下
下图所示装置进行实验。请回答下列问题:(加热及固定装置已略去)
(1)装置A中反应的化学方程式为
(2)装置C 中的试剂是( 填序号).
A.氢氧化钠溶液 B. 酸性高锰酸钾溶液 C.亚硫酸氢钠溶液
发生反应的离子方程式为,其说明了SO2具有,该实验操作的名称是。
(3)在上述实验中,能说明碳的非金属性比硅强的实验现象是
(4)B中的溶液无明显现象,当滴加氯水时有白色沉淀,写出SO2表现还原性并生成白色沉淀的总离子方程式为
脱水偶联反应是一种新型的直接烷基化反应,例如: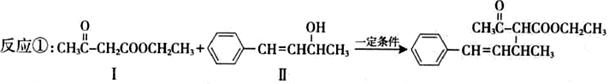
(1)化合物Ⅰ中含有的官能团的名称为,1mol该物质完全水解最少需要消耗
mol NaOH。
(2)化合物Ⅱ可使溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11C1)可与NaOH水溶液共热生成化合物Ⅱ,相应的反应类型为______.
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1:1:1:2,Ⅳ的结构简式为_______.
(4)化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ.Ⅵ的结构简式为______.检验Ⅵ中所含官能团,按使用的先后顺序写出所用试剂————————
(5)一定条件下,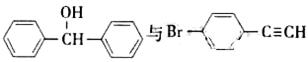
也可以发生类似反应①的反应,有机产物的结构简式为.
(1)某短周期主族元素的原子M层上有一个半充满的亚层,这种原子的质子数是 ___________,写出它的外围电子排布图___________。
(2)VIA族的.硒(Se).在化合物中常表现出多种氧化态, H2SeO4比H2SeO3酸性_-___(填强或弱),H2Se的酸性比H2S__________(填“强”或“弱”)。
(3)固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中正确的是 ( )
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔、沸点高于NH3 |
| C.NH5固体投入少量水中,可产生两种气体 |
| D.0.1 mol NH5中含有5 mol N—H键 |
(4)用氢键表示式写出HF溶液中存在的所有氢键。