2010年诺贝尔物理学奖授予英国的两位科学家,以表彰他们在石墨烯材料领域的卓越研究。科学家预测,该材料有可能代替晶体硅在电子工业的地位,从而引发电子工业的新革命。目前晶体硅在电子工业中的作用是
| A.制光导纤维 | B.制半导体 | C.制耐高温材料 | D.制硅橡胶 |
有下列三个反应方程式:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,下列说法正确的是 ( )。
| A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2 |
| B.根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+ |
| C.在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 |
| D.根据反应①②一定可以推理得到Cl2+FeBr2=FeCl2+Br2 |
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol·L-1 NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )。
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO3—的物质的量为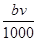 mol
mol
③反应过程中转移的电子数为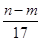 mol
mol
④标准状况下生成NO的体积为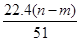 L
L
⑤与合金反应的硝酸的物质的量为(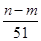 +
+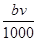 )mol
)mol
| A.5项 | B.4项 | C.3项 | D.2项 |
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是 ( )。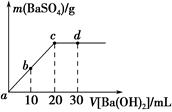
| A.硫酸溶液的体积为10 mL |
| B.b时刻溶液中SO42—的浓度约为0.125 mol·L-1 |
| C.d时刻溶液的pH为13 |
| D.溶液的导电能力:c<d<b<a |
设NA为阿伏加德罗常数的值。下列叙述正确的是 ( )。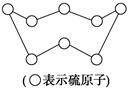
| A.3 mol NF3与水完全反应生成HNO3和NO,转移电子数2NA |
| B.标准状况下,32 g硫(结构见图)含SS的数目为NA |
| C.标准状况下11.2 L正戊烷所含共用电子对数为8NA |
| D.含a mol·L-1 H+的醋酸溶液稀释10倍后,c(H+)为0.1a mol·L-1 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )。
| A.常温下,4 g CH4含有NA个C—H共价键 |
| B.1 mol Fe 与足量的稀HNO3反应,转移2NA个电子 |
| C.1 L 0.1 mol·L-1 NaHCO3溶液中含有0.1NA个HCO3— |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |