《有机化学基础》
(1)具有明显现象的官能团特征反应常被用来鉴定化合物。
①欲区分CH2 =CH2和CH3 CH3 ,应选用 __ (填字母)。
a.NaOH溶液 b.溴水 c.银氨溶液
②欲区分HCHO和HCOOH,应选用 _ (填字母)。
a.KMnO4溶液 b.银氨溶液 c.Na2CO3溶液
③欲区分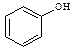 和
和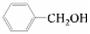 ,应选用 ___ (填字母)。
,应选用 ___ (填字母)。
a.FeCl3溶液 b.NaOH溶液 c.AgNO3溶液
(2)在有机化学中,同分异构是普遍存在现象。分子式为C4H9OH的有机物共有
种。其中,一种有机物通过消去反应可转变为2-丁烯,请写出该消去反应的化学方程式  ;另一种有机物的核磁共振氢谱图(1H核磁共振谱图)中显示一个峰,请写出该有机物的结构简式如下: 。
;另一种有机物的核磁共振氢谱图(1H核磁共振谱图)中显示一个峰,请写出该有机物的结构简式如下: 。
(3)A是石油裂解气的成分之一,A的某一同系物E的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成C6H12O2,其合成路线如下图所示: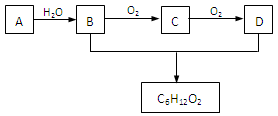
回答下列问题:
①A的结构简式为:______________。
②B、D分子中的官能团名称分别为_______________、_____________。
③写出B的同类别的同分异构体的结构简式:___________________。
④写出B→C的化学方程式:_______________________ __________________。
__________________。
已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为: H2RO4=H++HRO4-;HRO4 H++ RO42-回答下列问题:(1)NaHRO4溶液显(填“酸性”、“中性”或“碱性”),理由是_________
H++ RO42-回答下列问题:(1)NaHRO4溶液显(填“酸性”、“中性”或“碱性”),理由是_________
(用离子方程式和必要的文字说明)。
(2)Na2RO4溶液湿(填“酸性”、“中性”或“碱性”),理由是__________ (用离子方程式表示)
(3)如果25℃时,0.1 mol/L的NaHRO4溶液中,c(RO42-)=0.029 moL/L,则0.1mol/L H2RO4溶液中c(RO42-)0.029 mol/L(填“<”、“>”或“=”),理由是。
(4)25℃时,0.1 mol/L的NaHR04溶液中,各离子浓度由大到小的顺序是。
)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。
(2)已知:N2(g)+ O2(g)=" 2" NO(g)△H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g)△H =" -" 746 kJ • mol-1
则反应CO(g) + O2(g)= CO2(g)的△H = kJ • mol-1
O2(g)= CO2(g)的△H = kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g)△H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为,该反应的平衡常数表达式K =。
2NH3(g)△H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为,该反应的平衡常数表达式K =。
(4) 在固定体积的密闭容器中,1.0×103kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
①K1K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
(1)将各有机物的序号填到对应分类中①CH3CH2CH3②CH2=CH—CH3 ③CH3COOCH3④H3C—OH⑤CH3CH2COOH醇:_______羧酸:_______ 烷烃: ______
⑥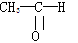 烯烃:_______酯:_______醛:_______
烯烃:_______酯:_______醛:_______
(2)如下图所示的核磁共振谱图是1-丙醇: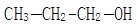 和2-丙醇:
和2-丙醇: 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为:
在浓硝酸中放入铜片:
①开始反应的化学方程式为。
②若铜有剩余,则反应将要结束时的反应的离子方程是:
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是。
有X、Y、Z三种元素:
①X、Y、Z的单质在常温下均为气体;
②X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③XZ极易溶于水,在水溶液中电离出X+和Z—,其水溶液能使蓝色石蕊试纸变红;
④每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤Z单质溶于X2Y中,所得溶液具有漂白性。
完成下列填空:
⑴试写出其元素符号:X_______,Y_______, Z_______,以及化合物的分子式:XZ_______,X2Y_________。
⑵写出Z单质与X2Y反应的化学方程式:。
⑶Z单质溶于X2Y中所得的新制溶液颜色为,该溶液具有漂白性是因为含有。