)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。(1)上图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+ O2(g)=" 2" NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H =" -" 746 kJ • mol-1
则反应CO(g) + O2(g)= CO2(g)的△H = kJ • mol-1
O2(g)= CO2(g)的△H = kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
(4) 在固定体积的密闭容器中,1.0×103 kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
①K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
在FeSO4溶液中滴加入少量KSCN溶液,溶液颜色,
再滴入几滴氯水,溶液颜色,因为有生成。
实验室配制的FeCl2溶液由于各种原因很容易变质,为了防止其水解,我们经常在里面加入____;为了防止其被氧化,经常加入_____,相应的化学反应方程式为_________________。_______
将铝条进入硝酸汞溶液中,取出后用滤纸吸干,露置于空气中,看到的现象是________,其原理是(化学方程式)_________________,___________________。
(1).切开钠的断面呈____色,有____光泽,能用小刀切割,表明钠的硬度____.
金属钠____导电,密度____,熔 点_____
点_____
.(2).切开的光亮的金属钠断面在空气中会______,原因是____________________,反应的化学方程式为__________,若金属钠在空气中燃烧,则 生成的是_____________,燃烧时火焰呈______色,反应的化学方程式_________________.
生成的是_____________,燃烧时火焰呈______色,反应的化学方程式_________________.
(3)..将一小块金属钠投入水中,反应的化学方程式为_______,其中____是还原剂,_______是氧化剂.
.如下图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答: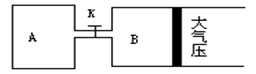
(1)B中X 的转化率α(X)B为
(2)A中W和B中Z的物质的量的比较:n(W)An(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为升(用a表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是。
(10 分)(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的P亚层上有3个电子。
①写出甲元素的电子排布式________________________;
②甲、乙元素的第一电离能关系为甲乙(填>、<、=);两元素可形成硬度大于金刚石的一种化合物,该化合物属于______晶体,其化学式为_____________,若使其熔化,需破坏的作用关系为___________________.
(2)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物,其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示:图中左右两边对称,各含一个近似为立方体的结构,每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一个化学键。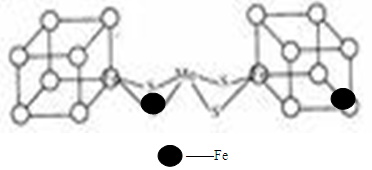
①请在图中左边立方体的○中填写出(在○涂黑)其余3个Fe原子
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______