在含有下列各离子组的溶液中,能大量共存且溶液为无色透明的是
| A.Na+、Cu2+、Cl-、SO42― | B.Ba2+、K+、OH-、NO3― |
| C.K+、Ca2+ 、NH4+、CO32― | D.H+、Ca2+、Cl-、HCO3― |
利用图装置,可以完成很多电化实验。下列有关此装置的叙述中,不正确的是()
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是()
| A.a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
| B.外电路电子的流向是从a到b |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.b电极上发生还原反应 |
锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是()
| A.锂离子电池放电时电池反应为LiMO2+C6Li1-x=C6Li+Li1-xMO2 |
| B.锂离子电池充电时电池内部Li+向负极所连的电极移动 |
| C.锂离子电池放电时电池内部电流从负极流向正极 |
| D.锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-=C6Li |
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为: 4VB2 + 11O2→4B2O3 + 2V2O5。下列说法正确的是()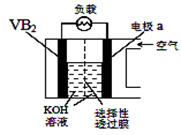
| A.电极a为电池负极 |
| B.VB2中V的化合价为+4价 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为:2VB2 + 22OH−-22e−=V2O5 + 2B2O3 + 11H2O |
以石墨电极电解200 mL CuSO4溶液,电解过程中转移电子的物质的量n(e—)与产生气体体积V(g)(标准状况)的关系如下图所示。下列说法中正确的是( )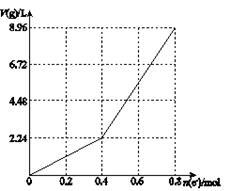
| A.电解前CuSO4溶液的物质的量浓度为2mol/L |
| B.电解后所得溶液中c(H+)=2mol/L |
| C.当n(e—)=0.6mol时,V(H2)∶V(O2)=3∶2 |
| D.向电解后的溶液中先后加入16gCuO和3.6g水,则溶液可恢复为电解前的浓度 |