(1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是 。
(2)向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉 淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2
淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2 S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
(3)现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是_______________
①20 mL 0.01 mol·L -1KCl溶液 ②30 mL 0.02 mol·L-1CaCl2溶液
-1KCl溶液 ②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液 ④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。此电池的负极发生的电极反应式是______________________ ;
(1)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃10kPa下,10g甲醇燃烧生成CO2和液态水时放热226.8kJ。请写出表示甲醇燃烧的热化学方程式:
(2)某些化学反应可用下式表示:A + B  C + D + H2O
C + D + H2O
请回答下列问题:
①若A、D均可用于消毒,且C是家家户户的厨房必备的调味品之一,写出该反应的离子方程式。
②若A为水垢的主要成分之一,B是日常生活常见有机物(厨房用品),
写出该反应的化学方程式:。
③若C、D均为气体且都能使澄清石灰水变浑浊,则只用
或(任写两种试剂的名称)就可以鉴别C、D两种气体。
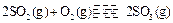 反应过程的能量变化如图所示。已知
反应过程的能量变化如图所示。已知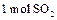 氧化为
氧化为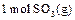 的
的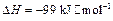 。请回答问题:
。请回答问题:
(1)图中A、C分别表示、,E的大小对该反应的
反应热有无影响?。该反应通常用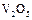 作催化剂,加
作催化剂,加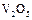 会使图中
会使图中
B点升高还是降低?,理由是 。
(2)图中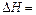
 。
。
(3)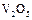 的催化循环机理可能为:
的催化循环机理可能为: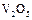 氧化
氧化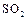 时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 。
时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 。
(4)如果反应速率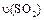 为
为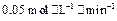 ,则
,则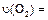
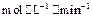 、
、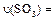
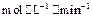 。
。
(5)已知单质硫的燃烧热为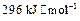 ,计算由
,计算由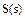 生成
生成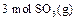 的
的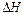 。
。
某厂的酸性工业废水中含有一定量的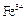 、
、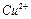 、
、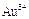 等离子。有人设计了如图所示的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
等离子。有人设计了如图所示的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。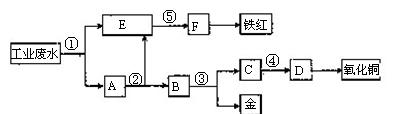
填写下面空白。
(1)图中标号处需加入的相应物质分别是①、②、③、④、⑤。
(2)写出①处发生反应的离子方程式;
写出③处发生反应的化学方程。
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜。
(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
则: B是____ __溶液(填溶质的化学式,下同),C是______,
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种可能:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:(ⅰ)上述关系一定不正确的是__(填序号)。
(ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为__(填上列四种情况之一的序号);
(ⅲ)若四种离子浓度关系有c(NH4+)="" c(Cl-),则该溶液一定显__(填“酸性”、“碱性”或“中性”)。
Ⅰ.下列有关实验操作中,合理的是_____(填序号)。
| A.用托盘天平称取11.70 g食盐 |
| B.用量筒量取12.36 mL盐酸 |
| C.用酸式滴定管量取21.20 mL 0.10 mol/L H2SO4溶液 |
| D.用200 mL容量瓶配制500 mL 0.1 mol/L NaCl溶液 |
E.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸装在滴定管中去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是______ ____。
(2)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度__(选填“偏大”、“偏小”或“无影响”)
Ⅲ、在由锌和石墨作两极材料、硫酸钠与硫酸铜组成的混合溶液作电解质溶液所形成的原电池中,正极上发生的反应的电极反应式是:。