A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
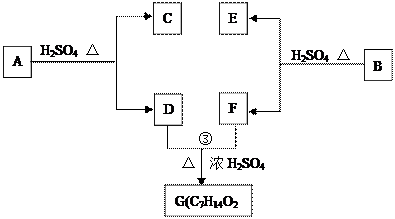
(1)化合物C的分子式是C7H8O ,C遇FeCl3溶液显紫色,核磁共振氢谱表明C分子中有4种不同化学环境的氢,则C的结构简式为___ ____。
,C遇FeCl3溶液显紫色,核磁共振氢谱表明C分子中有4种不同化学环境的氢,则C的结构简式为___ ____。
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为___________,D具有的官能团名称是_____________。
(3)反应①的化学方程式是______________________________________________。
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是_____________________________ _________。
(5)E可能的结构简式是__________________ ___。
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知未知X。
(1)已知KBrO3在反应中得到电子,该反应的还原剂是__________。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______。
(3)根据上述反应可推知_______。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4> KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方向和数目:
现有4.6gNa、2.4gMg、2.7gAl和6.4gCu,分别将其投入盛有100mL1.5mol/L盐酸的4个烧杯。
(1)各烧杯中可能发生反应的化学方程式为:___________、_____________、__________、______________。
(2)反应结束后,没有剩余的金属是:__________(填元素符号);
(3)反应结束后,产生气体的物质的量分别为:
①投入Na的烧杯,生成气体____mol;
②投入Mg的烧杯,生成气体____mol;
③投入Al的烧杯,生成气体____mol;
④投入Cu的烧杯,生成气体____mol;
物质A~E均含同种元素,都是中学化学中常见的物质,它们可发生如图所表示的反应。已知A是一种淡黄色的固体,B是银白色金属单质。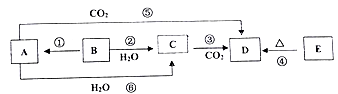
(1)反应⑤可用于潜水艇中制取氧气,相关的化学方程式为:__________________,氧化剂是______,还原剂是______;
(2)根据反应②相关的现象,从表格下方找出相应性质序号填在表格中,并在对应的位置写上该反应的化学方程式。
| 现象 |
单质B的相关性质(填序号) |
相关的化学方程式 |
|
| I |
单质B浮在水面上 |
||
| II |
熔成一个小球 |
||
| III |
四处游动,发出嘶嘶的声音 |
||
| IV |
滴入酚酞试剂,溶液变红 |
与反应现象相应的性质:①反应后生成了酸性物质;②反应后生成了碱性物质;③单质B的熔点低;④单质B的密度比水的小;⑤生成了气体;⑥单质B的密度比水的密度大;
(3)D和E分别与等浓度的盐酸反应,相同条件下生成等体积的气体,则以下说法正确的是:
________(填序号)
①消耗D的质量较多;②消耗E的质量较多;③D消耗盐酸的体积更大 ④E消耗盐酸的体积更大
实验室常用NaOH溶液和氨水(NH3·H2O)两种碱溶液来制取不同的金属氢氧化物,请选择合适的试剂来制取以下的金属氢氧化物:
(1)要制取Fe(OH)3时,可用NaOH溶液与______(写化学式)反应,所得到的沉淀为____色,离子方程式为:____________。
(2)要制取Fe(OH)2时,可用NaOH溶液与______(写化学式)反应,所得到的沉淀为____色,离子方程式为:____________。
(3)要制取Cu(OH)2时,可用NaOH溶液与______(写化学式)反应,所得到的沉淀为____色,离子方程式为:____________。
(4)要制取Al(OH)3时,可用氨水与______(写化学式)反应,所得到的沉淀为____色,离子方程式为:____________。
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有____性(填氧化性或还原性)。铁粉也可以将Fe3+转变为易吸收的Fe2+,离子方程式为:_________________。
(2)印刷电路板是高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”溶解铜箔,生成CuCl2和FeCl2相关的化学方程式:________________________。