铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O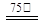 ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O ……………(b)
(1)上述制备原理中属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ、(NH4)2Fe(SO4)2·6H2O,Ⅱ、ZnSO4·7H2O及Ⅲ、(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n(Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,然后升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤干净的依据是 _________________。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有: 和 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4溶液。实验中可选用的试剂如下: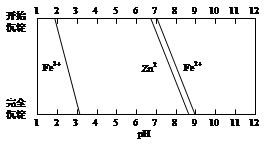
a.30%H2O2;
b.新制氯水;
c.1.0 mol·L-1NaOH溶液;
d.3 mol·L-1稀硫酸;
e.纯ZnO粉末;
f.纯锌粉。
实验步骤依次为:①将锌片完全溶于稍过量的3 mol·L-1稀硫酸,加入 (选填字母,下同);②加入 ;③加热到60℃左右并不断搅拌;④过滤得ZnSO4溶液。其中步骤③加热的主要目的有 。
保护环境是我们共同关注的社会问题。
(1)当空气受SO2污染时,可通过飞机喷洒X粉末,使空气中的SO2含量降低,该过程发生的反应是:2X +2SO2+O2==2CaSO4 +2CO2,X的化学式为 。
(2)为限制二氧化碳的排放,科学家采取“组合转化”技术,将二氧化碳和氢气在催化剂和加热条件下转化为乙烯(C2H4)和水,该反应的化学方程式为 。
(3)煤的气化过程会产生物质A和B,A和B在一定条件下反应生成C和D,微观过程如下图所示。该反应中,B和C的质量比为 。物质C是一种清洁燃料,其完全燃烧的化学方程式为 。
请用所学化学知识解释下列原理。
(1)上海世博园内安装的“直饮水”机,采用“活性炭+超滤层+紫外线”净水工艺。活性炭在此起____作用。
(2)酸雨造成的危害主要有:①腐蚀建筑物;② 等。解决酸雨的措施有 等。
(3)小华的爸爸发现自己种植的棉花叶面发红、发黄,且植株比别人种植的棉花明显矮小,出现上述情况你认为应施用 肥。请用化学方程式表示草木灰与碳铵不能混合施用的原因 。
(4)图中“──”表示两端的物质间能发生化学反应,其中X是初中化学中常见的化合物且具有挥发性,请回答:
①试写出X与Fe2O3反应的化学方程式 。
②试写一个工业上制取X的反应 。
在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如右图所示,
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式。
(2)该氢氧化钠溶液的物质的量浓度为mol·L—1。
(3)在B点,a12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中性,则混合前c(NaOH)____ c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:c(H+)________ c(OH-)。
(4)在D点溶液中离子浓度大小关系为。
根据表中左栏信息,回答右栏有关问题:
| 信息 |
问题 |
| ①短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数。其中X是形成化合物种类最多的元素。 |
(1)X元素的最高价氧化物的电子式是 |
| ②在一定条件下,上述四种元素的单质均能与足量的氧气反应,其中Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液。 |
(2)Z元素在元素周期表中位于第_____周期,_____族。 |
| ③Y固体单质与盐酸反应,再向反应后的溶液中加入过量的烧碱溶液,最终溶液中有白色沉淀生成。 |
(3)写出生成白色沉淀的化学方程式。 |
| ④向上述四种元素的单质的混合物中加入足量的烧碱,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀。 |
(4)最终生成白色沉淀的离子方程式为。 |
| ⑤X、Y、Z、W四种元素的原子半径由大到小的顺序为____________(用元素符号表示) |
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为;
(2)反应开始至5minZ的平均反应速率为;
(3)5min后Z的生成速率比5min末Z的生成速率(大、小、相等)。