T ℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1℃和T2℃时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是: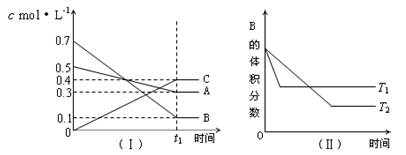
A.该平衡体系的化学反应方程式为:A(g)+B(g) 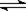 C(g)
C(g)
B.(t1+5)min时,保持容器容积不变,通入稀有气体,平衡向逆反应方向移动
C.在t1时间内用B表示该反应的平均速率为0.6/ t1 mol·L-1·min-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
已知X元素的某种同位素的氯化物XCln为离子化合物,在该化合物中X元素的微粒的核内中子数为m ,核外电子数为y,则该同位素的符号是:
A.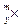 |
B.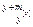 |
C.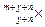 |
D.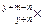 |
A、B、C、D、E 是同一短周期的五种元素, A和B的最高价氧化物对应的水化物呈碱性, 且碱性前者强于后者, C和D的气态氢化物的水溶液呈酸性, 且酸性前者强于后者, 五种元素形成的简单离子中,E的离子半径最小, 则它们的原子序数由大到小的顺序是
A. B A D C EB. E C D A B
C. B A E D CD. C D E B A
已知主族元素A和B的原子序数分别为a和b, 且原子半径为B > A , 则下列说法中正确的是
| A.a 一定大于b | B.若A和B不在同一周期, 则a一定大于b |
| C.a 一定小于b | D.若A和B在同一周期, a一定大于b |
A 和 B 是同周期的相邻元素, B 和 C 是同主族的相邻元素, 且A、B、C 最外层电子数之和为 19,则A、B、C三种元素分别是
A. N、 O、 S B. F、 O 、S
C. S、 Cl 、F D. O 、F 、S
下列有关性质的比较, 不正确的是
| A.酸性强弱: HI > HBr > HCl > HF | B.原子半径大小: Na > S > O |
| C.还原性强弱: F- > Cl- > I- | D.碱性强弱: KOH > NaOH > LiOH |