有下列三个反应:①Cl2+FeI2===FeCl2+I2 ②2Fe2++Br2===2Fe3++2Br- ③Co2O3+6HCl===2CoCl2+Cl2↑+3H2O。下列说法正确的是( )
| A.①②③中的氧化产物分别是I2、Fe3+、CoCl2 |
| B.根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 |
| C.可以推理得到Cl2+FeBr2===FeCl2+Br2 |
| D.在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 |
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )
H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是 ( )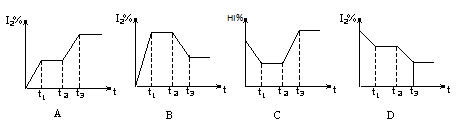
下列叙述正确的是 ( )
| A.铜锌原电池中铜是负极 |
| B.用电解法精炼铜时粗铜作阴极 |
| C.铅蓄电池放电时的负极在充电时作阴极 |
| D.电解稀硫酸制H2、O2时可用铜作阳极 |
COCl2(g) CO(g) + Cl2(g);△H>0当反应达到平衡时,下列措施:①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是()
CO(g) + Cl2(g);△H>0当反应达到平衡时,下列措施:①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是()
| A.①②④ | B.① ④⑥ ④⑥ |
C.②③⑥ | D.③⑤⑥ |
以下自发反应可用焓判据来解释的是()
| A.硝酸铵自发溶于水 |
| B.2N2O(g)===4NO2 (g) + O2(g)△H=+56.7kJ/mol |
| C.(NH4)2CO3(s)===NH4HCO3(s) + NH3(g)△H=+74.9kJ/mol |
| D.2H2(g) + O2(g)===2H2O(l)△H="-285.8kJ/mol" |
某同学为完成 2HCl+Fe=FeCl2+H2↑反应,设计了下列四个实验,如图所示,你认为不可行的是()