我校某化学小组欲设计实验检验浓H2SO4和木炭反应的所有产物:
(1)写出浓H2SO4和木炭反应的化学方程式
(2)请你从下图中选用所需的仪器(可重复使用)组成一套装置帮助该小组实现他们的目的.现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)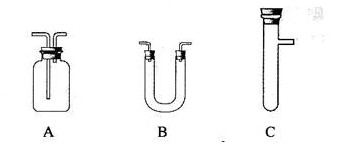
将所选的仪器按连接顺序由上至下依次填入下表(可以不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器 (填字母) |
加入的试剂 |
作用 |
| (1) (2) (3) (4) (5) · · · |
|
|
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
用化学符号回答下列问题:
(1)表中最活泼的金属与最活泼的非金属形成的物质是________ ;
(2)⑤、⑥、⑧的最高价水化物的碱性由强到弱的顺序是;
③、④、⑦氢化物稳定性由强到弱的顺序是;
(3)③与⑤按原子个数1:1所成的化合物的电子式为________________;该化合物与水反应的离子方程式为_______________。
(4)⑥号元素最高氧化物水化物与⑤号元素最高价氧化物水化物反应的离子方程式为__________ _;
(5)请设计一个实验方案,比较⑨、⑩的单质氧化性的强弱:。
一定温度下在10L容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生了反应,则:
(1)生成了_________molSO3,SO2的转化率为_________(用百分数表示)。
(2)平衡时容器内气体的总物质的量为_________。
(3)平衡时SO2的浓度是_________ ,O2的浓度是_________,SO3的浓度是_________ 。
下列反应属于放热反应的是_______;属于吸热反应的是_______
| A.锌粒与稀H2SO4反应制取H2 | B.氢气在氧气中燃烧 |
| C.碳酸钙高温分解成氧化钙和二氧化碳 | D.氢氧化钾和硫酸中和 |
E.Ba(OH)2·8H2O与NH4Cl反应F. C与CO2高温生成CO
G.葡萄糖在人体内氧化分解 H.钢铁制品生锈的反应
A、B、C是短周期元素中的三种相邻元素,A、B为同周期元素,B、C为同主族元素,A、B、C的核外电子数之和为31。请回答下列问题:
(1)A、B、C的元素名称分别为:_________,_________,________;
(2)写出由A元素组成单质的电子式_________,画出C离子的结构示意图:_________;
(3)用电子式表示C的氢化物的形成过程。
在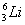 、
、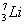 、
、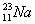 、
、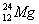 、
、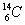 、
、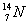 中:
中:
(1)和互为同位素;
(2)和的质量数相等,但不能互称同位素;
(3)和的中子数相等,但质子数不等,所以不是同一种元素