某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不均时会生成Fe3O4,也能被磁铁吸引。为了探究X的组成,他们进行了如下实验。
I、定性检验
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生 |
| ② |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少 量红色物质析出,仍有较多黑色固体未溶解 量红色物质析出,仍有较多黑色固体未溶解 |
由上述实验现象推断,黑色粉末X的成分是 。
II、定量测定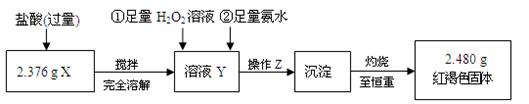
⑴ 操作Z的名称是 ,如图19的仪器中,在灼烧沉淀时必须用到的是 (填字母)。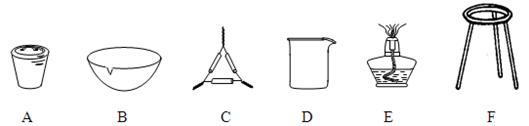
⑵ 写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:
。
⑶ 将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1- b2= 0.3 g,则接下来还应进行的操作是
。
⑷ 有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示):
。
⑸ 通过以上数据,得出2.376 g黑色粉末中各成分的物质的量为 。
(10分)(1)在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,则表示甲烷燃烧热的热化学方程式为_________________。
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为。
(3)如图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入(填序号).
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |

(4)下图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mole-发生转移时,左右两侧溶液的质量之差为(忽略气体的溶解,假设反应物完全耗尽)。
Ⅰ.常温下,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):______________________。
(2)混合溶液中由水电离出的c(H+)____0.1mol/LNaOH溶液中由水电离出的c(H+)。(选填“大于”、“小于”或“等于”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=_________mol/L。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH__________7(选填“大于”、“小于”或“等于”);
Ⅱ.相同条件下,有pH均为4的盐酸、硫酸、醋酸三溶液,其物质的量浓度依次为c1、c2、c3,则c1、c2、c3由大到小顺序为。
Ⅲ.已知海水中镁离子浓度为1.8×10-3mol/L,且Ksp[Mg(OH)2] =1.8×10-11,常温下要使海水中镁离子产生沉淀,溶液的pH最低应为。
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2 kJ,用H2表示的平均速率为。
(2)合成氨厂可用反应CO(g)+H2O(g) H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1 mol、1 mol、2 mol、2 mol,此时该反应由反应方向开始建立平衡。(选填“正”或“逆”)。
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为。
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有___________;
a.增加CO的用量 b.增加H2O(g)的用量
c.增大压强d.降低温度
(1)在下列空格上填出 “<” 或“>”
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol Q1Q2
②对于平衡m A(g) n B(g)+ p C(g),若降低温度时, A 的转化率增大,则ΔH10;若减压后正反应速率小于逆反应速率,则mn+p。
n B(g)+ p C(g),若降低温度时, A 的转化率增大,则ΔH10;若减压后正反应速率小于逆反应速率,则mn+p。
③常温下pH=12的烧碱溶液与pH=12氨水分别加水稀释至pH=10,所加水的体积前者后者。
(2)向CuSO4溶液中加入足量氨水可以得到深蓝色溶液,溶液显深蓝色是由于生成了一种离子,请写出该离子的离子符号。
工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl=CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是。
(2)工业上为除去溶液中的_________。溶液的pH变化是。
(3)若此溶液只含Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。