A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如图所示的变化。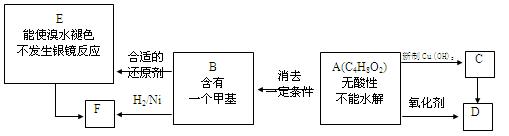
试回答:
(1)写出符合下述条件A的同分异构体的结构简式(各任写一种):
a.具有酸性,H-NMR谱图有3组峰________;
b.能发生水解反应,H-NMR谱图有4组峰_________。
(2)A分子中含氧官能团的名称是 ,D结构简式是 。
(3)写出化学方程式:A→B 。
(4)写出E生成高聚物的化学方程式: 。
(5)C的同分异构体C1与C有相同的官能团,两分子C1脱去两分子水形成含有六元环的C2,写出C1的结构简式(有几种写几种): 。
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为;W的电子式 。
(2)已知:①2E → E-E;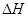 =-a kJ·mol-1② 2A → A-A;
=-a kJ·mol-1② 2A → A-A;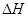 =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E;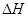 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);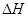 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 |
甲 |
乙 |
丙 |
| 初始投料 |
2 mol A2、1 mol BC |
1 mol X |
4 mol A2、2 mol BC |
| 平衡时n(X) |
0.5mol |
n2 |
n3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
放出Q3kJ |
| 体系的压强 |
P1 |
P2 |
P3 |
| 反应物的转化率 |
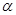 1 1 |
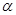 2 2 |
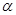 3 3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率 ( A2)为。
( A2)为。
②该温度下此反应的平衡常数K的值为。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是(填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。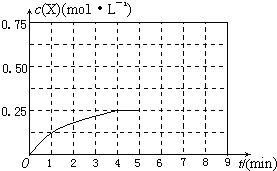
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原
理: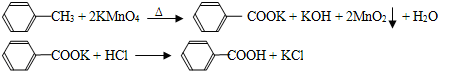
实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。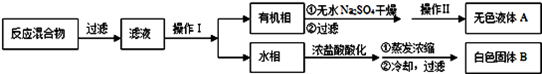
已知:苯甲酸相对分子质量122 ,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,需要用到的主要玻璃仪器为 ;操作Ⅱ为 。
(2)无色液体A是,定性检验A的试剂是 ,现象是。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容。
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
将白色固体B加入水中, 加热溶解, |
得到白色晶体和无色溶液 |
|
| ② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含Cl- |
| ③ |
干燥白色晶体, |
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 ml溶液,移取2 5.00 ml溶液,滴定,消耗KOH的物质的量为2.40 × 10 -3 mol,产品中苯甲酸质量分数的计算表达式为,计算结果为 。(保留两位有效数字)。
某芳香烃A是一种重要的有机化工原料,以它为初始原料经过如下转化关系(部分产物、合成路线、反应条件略去)可以合成邻氨基苯甲酸、扁桃酸等物质。其中D能与银氨溶液发生银镜反应,H是一种功能高分子。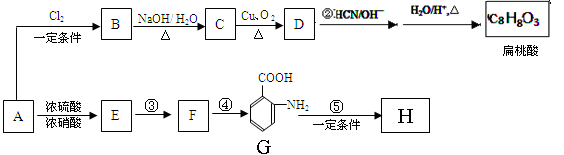
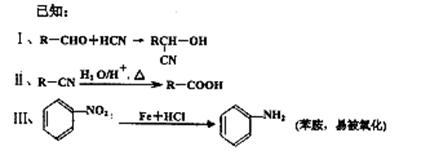
(1)写出扁桃酸的结构简式:;写出G官能团的名称 。
(2)反应②的反应类型为:;发生反应④的条件为加入。
反应步骤③与④不能对换,其理由是。
(3)写出D与银氨溶液反应的化学方程式:。
(4)写出反应⑤的化学方程式:。
(5)写出符合下列条件G的同分异构体的结构简式,;(任写两种)
①含有苯环,且苯环上的一氯取代产物只有二种;
②苯环上只有两个取代基,且N原子直接与苯环相连;
③结构中不含醇羟基和酚羟基;
(6)请设计合理的方案以乙烯为主要有机原料合成。
提示:①合成过程中无机试剂任选;② 合成路线流程图示例如下:
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是。
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为。
化学反应原理对于工业生产和科研有重要意义
I、下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
| 化学反应 |
平衡常数 |
温度 |
|
| 973 K |
1173 K |
||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) |
K3 |
? |
? |
请回答:
(1)反应①是(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 _____(填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时__________________; t8时__________________。
②若t4时降压, t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
II、(5)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为。
(6)某空间站能量转化系统的局部如图所示,其中的燃料电池采用KOH溶液作电解液。
如果某段时间内,氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为mol。