某同学称取9 g淀粉溶于水,测定淀粉的水解百分率。其程序如下:
淀粉溶液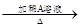 混合物
混合物
混合物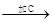 红色沉淀D
红色沉淀D
(1)各步加入的试剂为:
A________,B__________,C__________。
(2)加入A溶液而不加入B溶液是否可以________(填“可以”或“不可以”),其理由是_____________________________________________________________。
(3)若析出1.44 g红色沉淀,淀粉的水解率是__________。
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z_________W(填“>”、“<”或“=”,后同);电负性:X________Y。
(2)写出Q的价电子排布图_____________,YF3的结构式_____________,
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:答:________________________________________。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
Ⅰ.(1)X位于元素周期表中的位置______________;W的基态原子核外有_________个未成对电子。
(2)X的单质和Y的单质相比,熔点较高的是__________(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 ____________。
Ⅱ.部分化学键的键能见下表:
| 化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
| 键能/ kJ•mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“”“”)SiC________Si;SiCl4________SiO2
(2)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)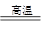 Si(s)+4HCl(g),
Si(s)+4HCl(g),
计算该反应的反应热△H=_________kJ·mol-1。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。
则CO2(g)+3H2(g)=CH3OH(g)+H2O(l)∆H= kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H 0,(填“>”或“<”)。若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”)。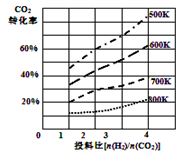
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。
| A.二氧化碳的浓度 | B.容器中的压强 |
| C.气体的密度 | D.CH3OCH3与H2O的物质的量之比 |
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32 -)= 。[已知:Ksp(CaCO3)=2.8×10-9]
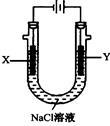
(4)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y 电极附近观察到的现象 ;当燃料电池消耗2.8L O2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式:____________。
(2)KCN溶液显碱性,原因是____________(用离子方程式表示)。
(3)下列有关方程式不正确的是____________。
| A.(CN)2+2NaOH===NaCN+NaCNO+H2O |
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O |
| C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
(4)25℃,0.1mol/LKOH溶液和0.2mol/LHCN溶液等体积混合,若溶液最终PH=8,则c(CN-) c(HCN),原因是 。此溶液中c(CN-)与c(HCN)差值的数值为:
(5)已知HCN可以在氧气中燃烧成CO2、H2O和N2,由此原理可以设计酸性条件下原电池,书写其负极反应式: 。
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:
(1)D、E所在周期原子最外层电子数为1的元素有____________种。
(2)A、B、C第一电离能由大到小的顺序为______________(用元素符号表示);
(3)B与C形成的二元化合物中,属于非极性分子的是________(填化学式);该分子中心原子的杂化类型为____________;
(4)E和F形成的一种化合物的晶体结构如图所示,则该化合物的化学式为______________;F的配位数为____________;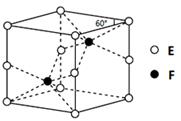
(5)D的离子可以形成多种配合物,由Dn+、Br-、C的最高价含氧酸根和A的简单氢化物形成的1:1:1:5的某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物的化学式为________;n值为________;Dn+的基态电子排布式为________;