如何设计A、B、C、D分别符合下述要求: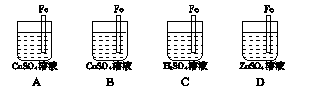
(1)A中Fe棒不溶解但质量增加 。
(2)B中Fe棒溶解,但Cu不在Fe上析出 。
(3)C中Fe棒不溶于H2SO4 。
(4)D中ZnSO4浓度不变 。
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑥ |
||||||
| 3 |
① |
③ |
④ |
⑦ |
⑨ |
|||
| 4 |
② |
⑧ |
请回答:(1)形成化合物种类最多的元素是(填元素符号)。
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是(填化学式)。
(3)①、②、③三种元素按离子半径由大到小的顺序依次为(填离子符号)。
(4)⑥元素形成的具有强氧化性的氢化物电子式是 , 该元素另一种氢化物在常温下与 ②发生反应的化学方程式为。
合成有机物G(C9H10O2)的过程如下,试回答下列有关问题。
(1)A的分子式为。
(2)C中的官能团的名称是;C转化为D的反应类型。
(3)E转化为F的过程中酸化的目的是。
(4)写出G与足量NaOH溶液反应的化学方程式:。
(5)符合下列条件的G的同分异构体数目为种:
①苯环上有3个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜。其中氢原子共有四种不同环境的所有物质的结构简式为、。
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。根据卤代烃的相关性质,回答下列问题
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为,请预测B的核磁共振氢谱上应该有个峰(信号)。
(2)某同学用如图1装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物。

实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和0.5 mL溴乙烷振荡。
实验操作Ⅱ:将试管如图1固定后,水浴加热。
①据图1:用水浴加热而不直接用酒精灯加热的原因是。
②图2是为证明溴乙烷在NaOH乙醇溶液中发生的是消去
反应,实验中需要检验的产物是,
水的作用是,
实验现象是。
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知: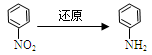 )
)
(甲苯)
(1)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(2)乙中有两种含氧官能团,反应③的化学方程式是:
(3)丙中官能团的名称是。
(4)普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
② 戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式
是。
(1)下列7种固态物质:P4(白磷)、NH4Cl、Ca(OH)2、NaF、CO2、金刚石,回答下列问题(填写化学式或名称):[来源*:%z#zstep.^co&m]
①熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________;
②晶体中既有离子键又有共价键的是________。
③P4(白磷)、SiO2、NaF、CO2四种晶体熔点由高到低的顺序为________。
(2)某元素最高正化合价为+6,其最低负价为________。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为________。