一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是__________________________。
(2)推测A中可能含有的金属阳离子:①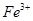 ;②只有
;②只有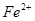 ;③_____________。
;③_____________。
甲同学为探究溶液的组成,实验如下:
| 实验步骤 |
实验现象 |
实验结论及反应离子方程式 |
| 取少量溶液A于试管中,加入KSCN溶液 |
_____________ |
假设②不成立,假设①或③成立;反应的离子方程式是__ _。 |
(3)乙同学继续探究溶液A的组成。
查阅资料: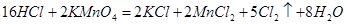
实验过程:另取少量溶液A于试管中,逐滴加入酸性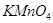 溶液,充分振荡,
溶液,充分振荡,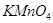 紫色褪去。
紫色褪去。
实验结论:_____________(填字母序号)。
a. 可能有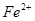 b. 可能无
b. 可能无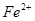 c. 一定有
c. 一定有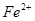
[物质结构与性质,13分]
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式。
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是(填化学式)。
| 键长/(pm) |
B—F |
B—Cl |
B—Br |
| 计算值 |
152 |
187 |
199 |
| 实测值 |
130 |
175 |
187 |
(3)三氟化硼分子的空间构型是;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如右表。硼卤键长实测值比计算值要短得多,可能的原因是。
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
①磷原子的杂化类型为。
②这种多聚磷酸钠的化学式为。
(5)已知HF与F-通过氢键结合成HF 。判断HF
。判断HF 和HF
和HF 微粒间能否形成氢键,并说明理由。
微粒间能否形成氢键,并说明理由。
。
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 |
Mg2(OH)2CO3 |
CaCO3 |
BaSO4 |
BaCO3 |
| 2.6×10-2 |
2.5×10-4 |
7.8×10-4 |
2.4×10-4 |
1.7×10-3 |
①检测Fe3+是否除尽的方法是________________________________________。
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因____________________。
③除去Mg2+的离子方程式是_______________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测_______(填离子符号)。
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下: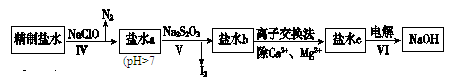
①过程Ⅳ除去的离子是________________。
②盐水b中含有SO42-。Na2S2O3将IO3-还原为I2的离子方程式是________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:___________。
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
2KNO3+3C+S K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
(1)上述反应中,原子半径最小的元素其原子结构示意图为________________。
(2)上述反应生成物中,属于非电解质的是________。
(3)上述反应中,每生成1 mol氧化产物,消耗KNO3的质量为(保留1位小数)。
(4)收集黑火药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质是(填化学式)。
②气体产物与酸性高锰酸钾溶液反应的离子方程式。
③利用下图装置检验气体产物中的CO气体,一段时间后,观察到B中出现黑色的Pd沉淀,写出B中发生反应的化学方程式。
[化学——有机化学基础]
有甲、乙、丙三种物质: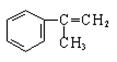


甲乙丙
(1) 乙中能发生消去反应的官能团为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的部分产物,下同):
反应Ⅱ的条件是NaOH溶液、加热;反应III的化学方程式为________________________
(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下: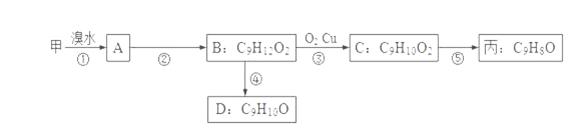
①下列物质不能与B反应的是___________(选填序号)。
a.金属钠 b.FeCl3溶液 c.Na2CO3溶液 d.HBr溶液
②C的结构简式为 __________________________;第⑤步反应类型______________________
③任写一种能同时满足下列条件的D的同分异构体的结构简式______________________。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液发生显色反应 c.能与Br2/CCl4发生加成反应
[化学——物质结构与性质]
I.氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是。
a.N2可用于填充霓虹灯,其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道时以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是。
向硫酸铜溶液中先加过量氨水,后加适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,
该晶体中不含有的化学键是。
| A.极性键 | B.非极性键 | C.离子键 | D.配位键 E.氢键 |
Ⅱ. 第四周期金属与人类的生产生活息息相关。
(3)目前市售的发光二极管,其材质以砷化镓(GaAs) 为主。已知镓是与铝同族,镓的基态原子的电子排布式是 。GaAs中Ga的化合价为 。
(4)金属钛坚硬、强度大、耐热、密度小,被称为高技术金属。TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟, 则TiCl4属于 (填“原子”“分子”或“离子”)晶体。
(5) 钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生白色沉淀; 往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时, 产生淡黄色沉淀,则第二种配合物的化学式为 。